百因Bi(铋)有果,氨的合成还看我!
QQ学术交流群:1092348845
详细介绍
众所周知,氨气在农业和工业发展中的地位举足轻重。传统的氨气制备依靠Haber−Bosch合成法,消耗了大量的能源且造成严重的环境污染。因此,应运而生其他电化学还原反应的电催化剂,用水作为氢的来源,把氮气还原为氨气。电化学还原反应合成氨的方法(图1),例如光催化产氨、电催化产氨以及光电催化产氨[1]。其中电催化氮气还原合成氨由于其低成本和条件可控受到越来越多的关注,呈现了井喷的发展态势。
图1. 合成氨的三种新途径[1]。
发展历程
近年来,有关电催化氮气还原合成氨的文献越来越多,因此对于氨产物的确定就显得尤为关键。根据NRR电催化剂文献报道分为以下几类:金属、氮化物、以功能载体为中心的活性催化剂复合材料和金属硫族化合物。尤其是最近几年,常温常压电催化合成氨方向的文献大幅增加,各种高性能的催化剂日新月异,节节攀升,随之而来的争议也越来越多。那么对于数据的可靠性和实验结果的可重复性,也受到多方的探讨。对于氮还原反应的假阳性结果真相的探究,可以参考乔世璋团队在此方面的文献。文献信息:Electrochemical Nitrogen Reduction: Identification and Elimination of Contamination in Electrolyte (ACS Energy Lett., 2019, DOI: 10.1021/acsenergylett.9b01573)制备高效NRR电催化剂催化机理分析NRR反应机制分为解离和非解离机制(图2),解离机制(Dissociative pathway):氢化反应前N≡N键断开,催化剂表面把N原子吸附,进行氢化反应转变为NH3。非解离机制(Associative pathway):N2在氢化反应时,N≡N键仍未断开,有两种机制(Associative distal pathway 和Associative alternating pathway)形成中间产物,最终使N≡N键断开,形成NH3。
图2. NRR反应机制[3]。

那么对于氮气分子的活化就需要催化剂表面能够吸附N2,另一方面就需要催化剂能够有更高的选择性,与强烈的析氢反应竞争。那么就需要开发能够抑制析氢副反应,限制质子和电子向催化剂表面扩散。从DFT理论计算来看,为了获得高的NRR选择性,可以通过控制质子的浓度和活性来抑制副反应HER。从动力学角度看,NRR反应不太可能受到质子浓度的限制,除非达到一定的低浓度,此时质子到电极的质量输运量不足以与NRR速率相匹配[2-4]。为控制质子源供应,可使用添加适量水、酸或碱的非质子电解质。从目前来说,Fe、W、Mo、Ru被公认是最高效的NRR催化剂。
电催化剂性能对比
表1. 总结不同电催化剂性能比较[5,6]。

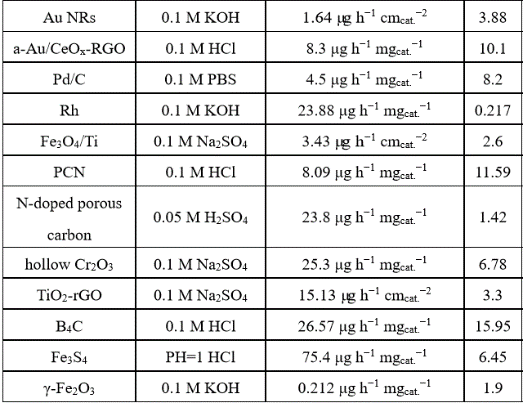
从表1数据来看,Ru、Fe基催化剂氨的产生速率和法拉第效率较高,贵金属Au对于NRR也有很好的催化活性。此外,稀土元素Ce也在这个领域开始呈现不错的态势。然而,催化剂的氨气产生速率和法拉第效率很难同时具备最优的性能。亟待解决的问题是如何同时兼顾二者之间的关系,抑制竞争反应HER,同时减小NRR的过电位。使催化剂获得高的电催化NRR选择性,可以通过控制质子的活性和浓度来抑制竞争反应-析氢反应。催化剂在选择性和速率方面传统的催化剂大多选择的是析氢反应活性较好的过渡金属,其他应用于电催化反应,如二氧化碳还原的金属基材料,是否也能应用于电催化氮气还原呢?首先从理论计算上来看(见下图3自由能计算),Fe、W、Mo、Ru这些金属都满足这个条件(从图3左上角绿色区域看出)。
图3. N与H在金属表面的相对吸附能表面覆盖理论[3]。
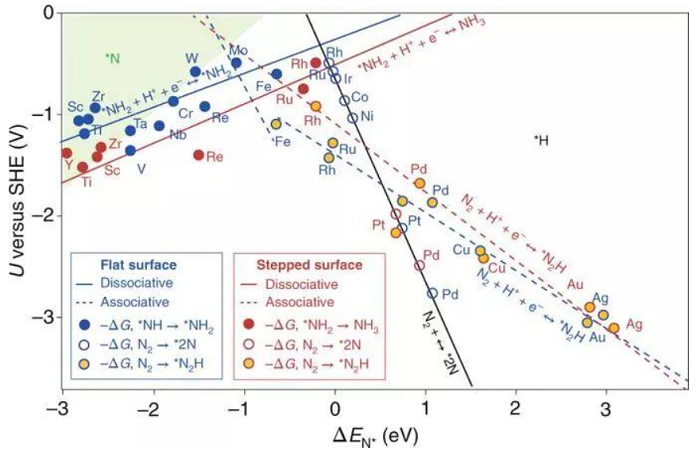
那对于其他金属,例如应用于光催化的铋基材料是否也满足这个条件呢?
表2.关于Bi基催化剂在NRR应用的总结

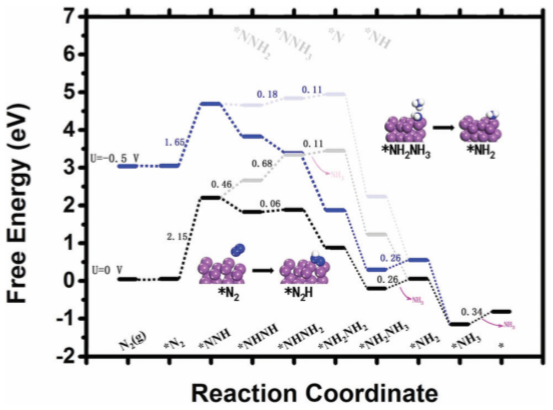
从汇总的数据显示,铋基材料对于NRR反应也有良好的选择性、催化效率和速率。从理论计算来看Bi NS/CF(Bi 纳米片排列在 Cu foil上),图4为理论计算的自由能分布图,反应发生在Bi(012)表面。
图4. Bi NS/CF在NRR不同施加电势下的自由能分布,星号(*)表示吸附部位[5]
另外对没有基底泡沫铜的Bi纳米片(Bi NS)查看它的NRR催化性能。图5d显示铋原子可以有效提供p轨道电子,从而活化氮气分子。进一步通过X射线精细吸收谱分析,层间Bi-Bi键键长缩短可以有效促进Bi的p轨道电子离域化,从而强化其对N2的吸附和活化。
图5. Bi NS在NRR不同施加电势下的自由能分布,星号(*)表示吸附部位[9]。
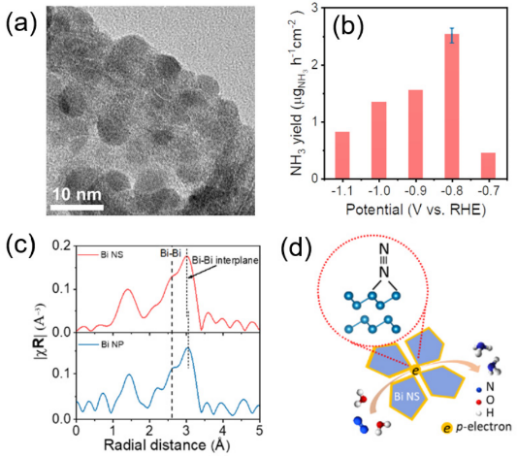
图6. Bi NS在NRR过程之前(a)和之后(b)的扫描图片[9]。

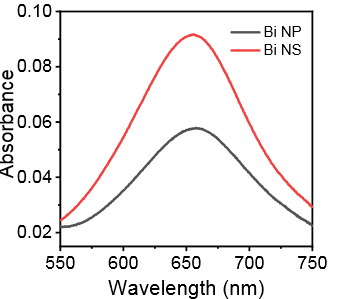
Bi纳米片在进行NRR测试后仍然能够保持之前的形貌(图6),表明该催化剂通过原位电化学还原的方法拥有优异的氮气还原性能。相比于Bi的纳米粒子(Bi NP),能够暴露更多的边缘活性位点,提高催化反应的选择性。图7,比较Bi NP和Bi NS进行NRR电解后的紫外吸收光谱,直接得出铋纳米片相对于铋纳米粒子有更好的催化产氨性能。
图7. Bi NS和Bi NP的UV-vis图谱[9]。
稳定性及周转频率稳定性
图8. Bi2MoO6 / CP在N2饱和溶液中,时间与电流密度曲线中电解24小时电压(–0.6 V)[8]
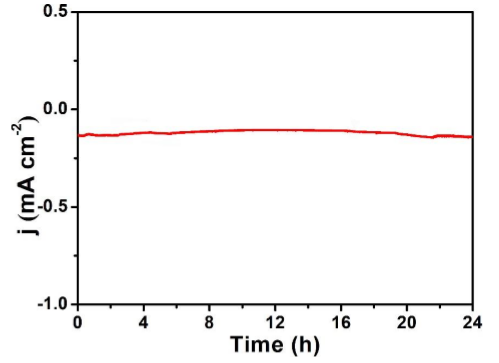
电催化剂的稳定性测试时间至少超过5个小时,且具有持续的活性。周转频率此外,该领域的另一个重要指标是,催化剂的周转频率需要大于1。总结
电催化氮气还原是一种可持续的氨合成的工艺,它的催化剂设计取决于电极/催化剂/电解质的组合。对于如何建构优异的催化剂,电催化氮气还原催化剂的结构,或催化剂与电解质组合也是提高催化选择性的一种途径。对于能源效率,关注催化剂的特性是一个关键的策略,通过构筑缺陷工程、对催化剂表面改造和提供低过电位等步骤,在理论力学的研究是确定这些可能性的关键,特别是在寻找提供低能量机制的特定表面特征方面。另外,对于统一数据报告中,氨气产生的速率应该使用统一的量化标准,检测方法也应该规范和统一,合成氨之路漫漫而又充满希望!参考文献[1] Li, M., Huang, H., Low, J., Gao, C., Long, R., & Xiong, Y. Small Methods, 2018, 1800388. [2] D. Bao, Q. Zhang, F. Meng, H. Zhong, M. Shi, Y. Zhang, J. Yan, Q. Jiang and X. Zhang, Adv. Mater., 2017, 29, 1604799.[3] S. L. Foster, S. I. P. Bakovic, R. D. Duda, S. Maheshwari, R. D. Milton, S. D. Minteer, M. J. Janik, J. N. Renner and L. F. Greenlee, Nat. Catal., 2018, 1, 490–500.[4] L. Wang, M. K. Xia, H. Wang, K. F. Huang, C. X. Qian, C. T. Maravelias and G. A. Ozin, Joule, 2018, 2, 1055–1074.[5] R. Zhang, L. Ji, W. Kong, H. B. Wang, R. Zhao, H. Chen, T. Li, B. Li, Chem. Commun., 2019, 55, 5263—5266.[6] L. Zhang, X. Ji, X. Ren, Y. Ma, X. Shi, Z. Tian, A. M. Asiri, L. Chen, B. Tang and X. Sun, Adv. Mater., 2018, 30, 1800191.[7] C. Lv, C. Yan, G. Chen, Y. Ding, J. Sun, Y. Zhou and G. Yu, Angew. Chem., Int. Ed., 2018, 57, 6073–6076.[8] Z. Xing, W. H. Kong, T. W. Wu, H. Xie, T.Wang, Y. Luo, X. Shi, and X. P. Sun. ACS Sustainable Chem. Eng., 2019, 7, 12692−12696.[9] L. Q. Li, C. Tang, B. Q. Xia, H. Jin, Y. Zheng and S. Z. Qiao, ACS Catal., 2019, 9, 2902.
信息来源:
- 上一款: 石墨烯具有修补自身的能力
- 下一款: 综述:石墨烯作为透射电子显微镜超薄透明载体的

 技术前沿
技术前沿