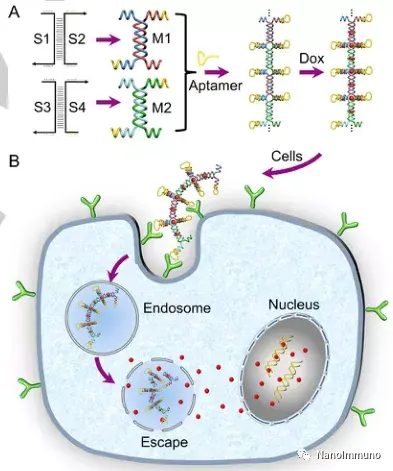
DNA纳米结构已显示出在癌症治疗中的潜力。然而,当前的临床实践由于难以将它们递送到癌细胞中以及对核酸酶降解的敏感性而受到阻碍。为了克服这些局限性,本文报告了一种具有高血清稳定性和主动靶向功能的DNA纳米线(NW)。内核由多重连接的DNA双螺旋制成,外壳由规则排列的直立发夹适体组成。暴露于靶标结合位点以允许递送至癌症靶标时,组分的所有末端都不会受到核酸酶攻击。在血清溶液中孵育24小时后,DNA NW保持完整。动物显像和细胞凋亡表明,NW配制的抗癌药物具有长的血液循环时间,并且在诱导癌细胞凋亡方面具有很高的特异性。荷瘤小鼠的治疗验证了体内治疗效果,证明可有效用于靶向成像和癌症治疗。
本文证明了均匀、生物相容且有序排列的核/壳NWs-Aptamer纳米载体显示出核酸酶抗性和细胞靶向能力的显着提高。线性核的生长可以通过改变两个模块的摩尔比来调节,这两个模块的粘性末端适合于进一步组装成血清稳定的外层。通过围绕线性DNA双螺旋核心,形成癌细胞保护性适体的发夹状突起。DNA NWs-Aptamer纳米载体在血清溶液中孵育24小时后保持其结构完整性,从而延长了血液循环时间。
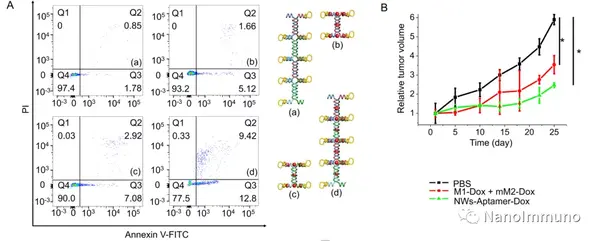
此外,DNA载体具有显著增强的载药能力和癌细胞靶向能力,包括改善的结合亲和力和特异性,共同有助于出色的靶向药物递送。共聚焦荧光成像和流式细胞仪分析表明,DNA NWs-Aptamer-Dox可以特异性诱导癌细胞凋亡,而不会检测到对非靶细胞的不利影响。NWs-Aptamer-Dox的体内抗肿瘤功效也得到了验证。这项工作显示出几个优点,例如高载药能力,长血液循环时间,无修饰制剂,理想的结合亲和力,高特异性和良好的生物相容性。 NanoImmuno
扫码关注扫码关注我们 联系方式: 17319402180

本信息源自互联网仅供学术交流 ,如有侵权请联系我们立即删除。