癌症每年约有1000万患者死亡,占全球死亡人数的15%以上。1因此,迫切需要寻找新的抗癌治疗方法。目前的抗癌治疗往往有不良的副作用,而天然的抗癌药物已被证明不那么有效,需要较高的局部浓度来引起抗癌特性。乳铁蛋白具有多种治疗特性,包括抗癌、抗菌、抗寄生虫、抗病毒和抗真菌活性。2最近发现乳铁蛋白可以加covid-19.3感染患者的恢复,4该转铁蛋白类蛋白通过招募免疫相关细胞因子,通过金属离子隔离消耗病变区域的营养物质,表现出这些治疗活性。蛋白酶消化的乳铁蛋白通常会导致表现出改善治疗活性的片段。与全长乳铁蛋白(flHLF)相比,乳铁蛋白(肽消化的乳铁蛋白)具有更好的抗菌和抗真菌特性。
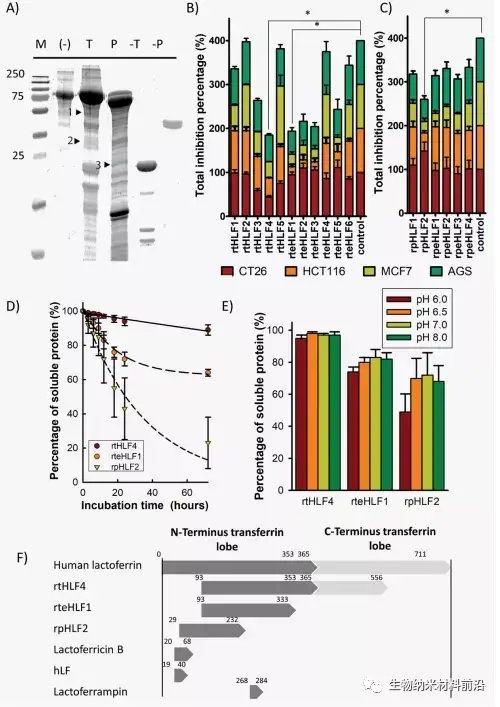
图1.抗癌乳铁蛋白片段的分离。(A)胰蛋白酶(T)和胃蛋白酶(P)消化的乳铁蛋白的SDS-PAGE。抗癌活性阳性的片段用箭头表示(M、标记物、T、胰蛋白酶、P、胃蛋白酶、1、rtHLF4、2、rteHLF1、3、rpHLF2)。(B)胰蛋白酶消化的乳铁蛋白片段的抗癌活性。(C)胃蛋白酶消化的乳铁蛋白片段的抗癌活性。(D)分离的乳铁蛋白片段在37°C下的稳定性。(E)12h后不同pH下纯化乳铁蛋白片段的稳定性。(F)分离片段与乳铁蛋白和其他乳铁蛋白衍生片段的序列长度(*Bonferroni校正后P≤0.0083;每组重复3次)。
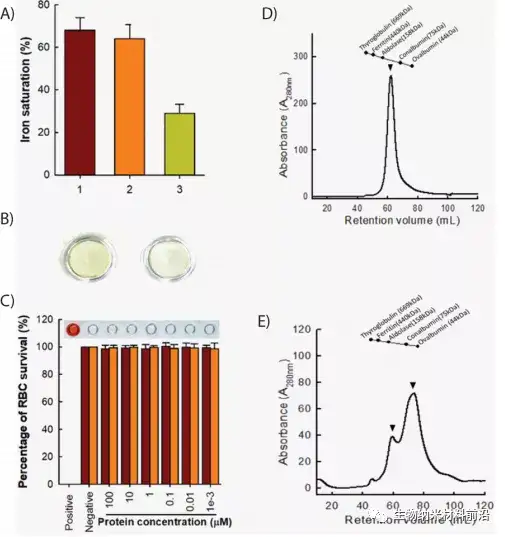
图2.rtHLF4的结构和生物安全分析。(A)乳铁蛋白和rtHLF4(1、商业乳铁蛋白、2、乳铁蛋白、3、rtHLF4的铁离子饱和率,每组重复3份)。(B)重组乳铁蛋白(左)和rtHLF4(右;0.1mM制备的样品)的颜色。(C)纯化的乳铁蛋白(maroon)和rtHLF4(橙色)对人红细胞的溶血试验(插图:使用相应的rtHLF4浓度的溶血结果;n=10,阳性对照,0.1mg/mL消炎痛)。(D)flHLF的尺寸排除色谱分离(蛋白质重量,80kDa)(箭头表示分离蛋白的二聚体构象)。(E)rtHLF4的尺寸排除分离(蛋白重量,51kDa;箭头表示分离蛋白的二聚体和单体构象)。
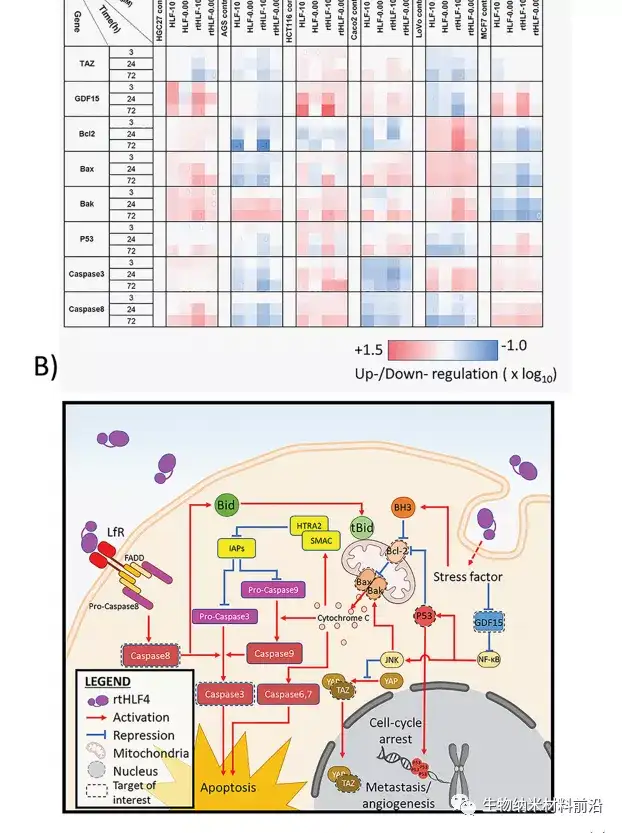
图3.flHLF和rtHLF4治疗后胃癌、结肠癌和乳腺癌细胞的抗癌机制。(A)胃癌、结肠癌和乳腺癌细胞中不同基因的定量PCR结果。将表达水平与管家基因GADPH(flHLF/rtHLF4−10:10μM的flHLF/rtHLF4;flHLF/rtHLF4的flHLF/rtHLF4−0.005:0.005μM)进行比较。(B)rtHLF4治疗引发的癌细胞的不同抗癌途径。
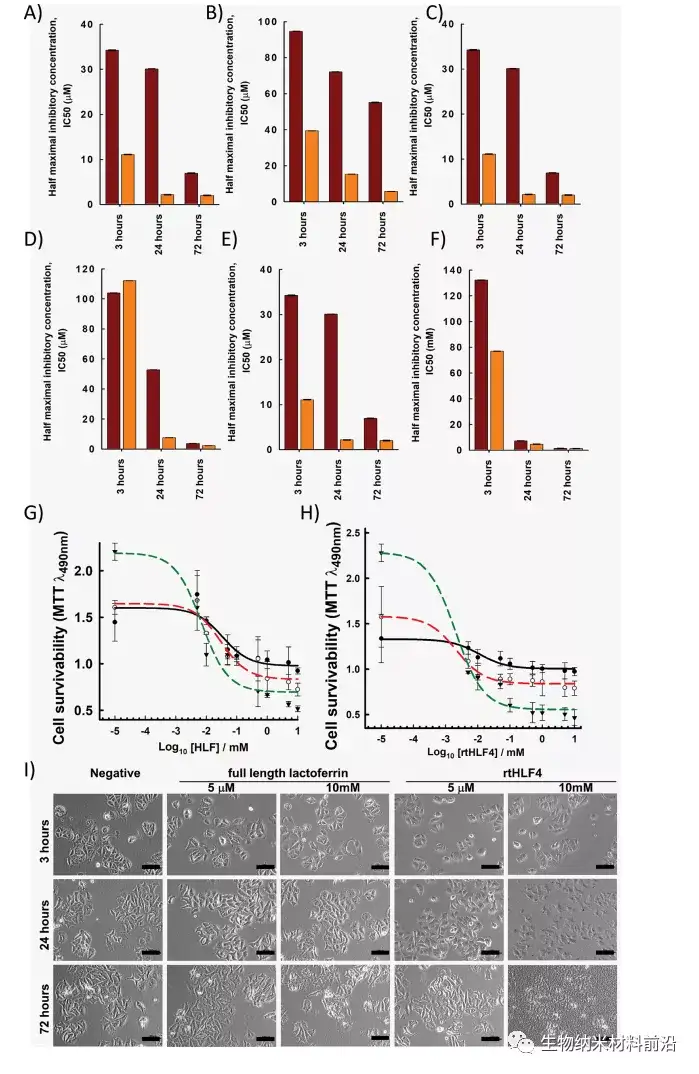
鉴定了三种蛋白酶消化的人乳铁蛋白片段,与flHLF相比具有更好的抗癌特性。其中,rtHLF4对人体生理条件的稳定性和耐受性最好。在进一步检查rtHLF4的机制,我们发现rtHLF4引起各种癌细胞受体相互作用通过乳铁蛋白类型,rtHLF4内化rtHLF4,抑制转移基因,从而表明该蛋白在未来癌症治疗中的潜在用途。在rtHLF4作为一种可行的治疗方法开发之前,需要进一步的研究来更好地了解其抗癌机制。这些研究包括对参与rtHLF4向细胞质内化的受体蛋白和结合蛋白进行更深入的研究。我们打算进一步研究这种相互作用,利用热接近共聚集来描述这些癌细胞内的蛋白质复杂动力学。24rtHLF4也可能作为抗癌治疗的合成生物学驱动细胞工程的输出机制。
http://n.ustb.edu.cn/https/77726476706e69737468656265737421e0e2438f69316b4330079bab/doi/10.1021/acsptsci.1c00134