已传文件:photo/1631586161.png
在各种疾病的治疗过程中,患者能否被成功治愈依赖于医生将药物递送到特定部位的能力,癌症是其中的典型例子,经过了一个世纪的发展,如今的治疗手段还是无法使药物集中于药物的作用部位,药物分子只是简单地在全身分布扩散,这容易引起人体不良的副作用并浪费大量药物。在长期对药物递送的研究中,学者发现纳米颗粒已成为克服常规药物制剂及其相关药代动力学限制的合适载体,如脂质体已被证明在溶解治疗药物方面具有优势,可以控制药物长期缓释,大大延长了药物的循环寿命。但药物递送过程中的生物屏障阻止了纳米药物载体在患病部位的积累,从而限制了药物治疗时的有效反应。尽管大量的研究工作旨在将多种功能纳入整个纳米颗粒设计,但其中许多策略未能充分解决这些障碍,例如非特异性分布和治疗药物积累不足,这仍然是药物开发人员面临的巨大挑战。除非纳米载体的设计能解决颗粒在静脉给药时遇到的大部分(如果不是全部)生物屏障,否则特定部位的治疗药物递送仍将是一个遥远的现实。因此我们可以针对药物递送中出现的生物屏障对纳米颗粒进行设计,合理地结合创新的设计特征,这将创造新一代的纳米治疗药物,实现基于纳米颗粒的药物递送的成功转变。
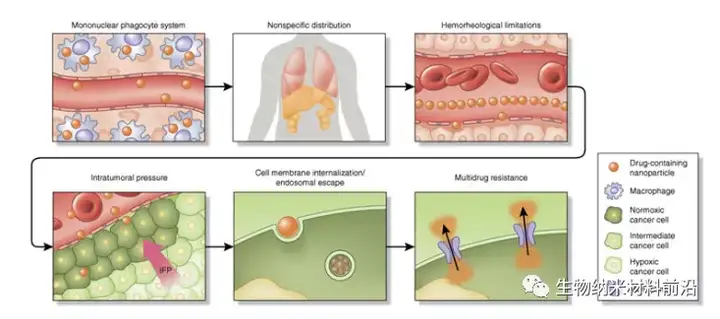
图1. 纳米颗粒药物递送的连续生物屏障框架。在静脉内给药时,含有药物的纳米颗粒会遇到许多阻碍有效的、特定于位点的递送障碍。纳米粒子经过调理作用,随后被 MPS 的常驻巨噬细胞摄取。这会使得纳米颗粒在器官(如脾脏和肝脏)中大量积累,从而导致纳米治疗药物向健康器官的非特异性分布。在血管的正常流动条件下,纳米颗粒的尺寸和几何形状血管壁的边缘动态有很大影响。小尺寸球形颗粒在无细胞层中迁移,距离内皮表面相当远,通过被动靶向机制(例如 EPR)限制了主动靶向策略和有效积累。肿瘤中纳米颗粒积累的另一个重要障碍是高肿瘤内压力,这是由中断的脉管系统、细胞生长的侵袭性、纤维化、致密的细胞外基质和受损的淋巴管引起的。细胞内化和内体逃逸被也是另一个强大的障碍,纳米颗粒的大小和表面修饰影响其内化途径(例如网格蛋白与小窝蛋白)和细胞内流向。在低 pH 值环境和酶作用下,内化纳米颗粒的内体区室化证明对细胞有害,尤其是对遗传物质。最后一个障碍是纳米颗粒在进入细胞后,赋予治疗抗性的药物外排泵将化疗药物从细胞中排出,IFP及间质液压力在其中起到关键作用。
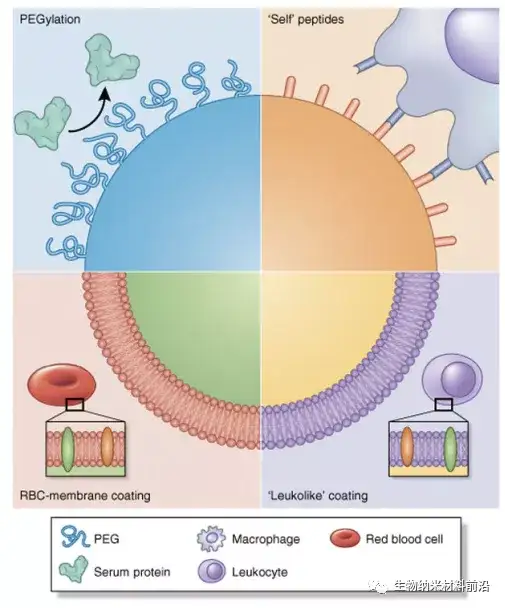
图2.用于避免 MPS 和延长循环的纳米颗粒仿生策略。MPS 的调理作用和契合已被证明不利于纳米颗粒的长循环时间,因此,我们使用了几种策略来“伪装”纳米粒子并防止蛋白质吸附。聚乙二醇化代表了一种经典的策略,其中将 PEG 接枝到表面提供了一个水合层,阻碍了蛋白质电晕的形成。在另一种策略中,CD47 肽附着在纳米颗粒的表面,然后巨噬细胞将纳米颗粒识别为“自身”,从而纳米颗粒避免吞噬作用。最后,用从自体白细胞和红细胞 (RBC)中提取的细胞膜涂覆纳米颗粒提供了一个仿生表面,显著延长纳米颗粒的体内循环。
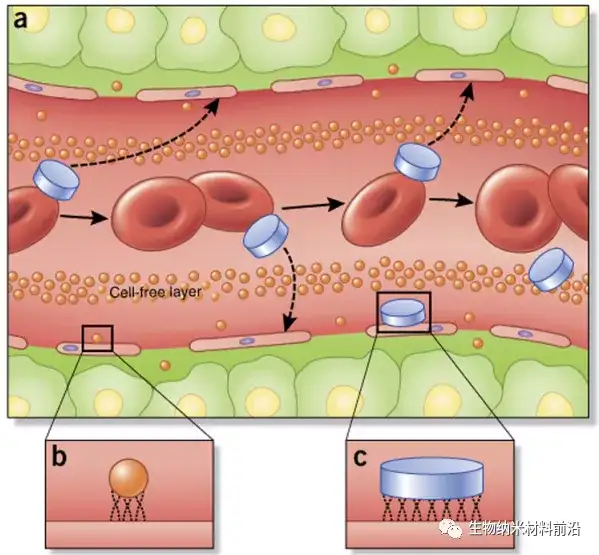
图3. 纳米粒子在血管中的流动、边缘和粘附特性取决于粒子大小和几何形状。 (a) 与球形纳米颗粒不同,非球形颗粒,例如那些具有盘状几何形状的颗粒,更容易在脉管系统中产生翻滚和振荡效应,大大增加了纳米颗粒与细胞壁接触的倾向以及通过脉管系统中的开窗可能外渗。(b,c) 一旦与内皮细胞接触,常规球形纳米粒子的小尺寸和表面积 (b) 与较大的盘状纳米粒子(c;以及其他非球形几何形状)相比,减少了结合和接触点的数量, 这会影响肿瘤的积累和主动靶向策略。
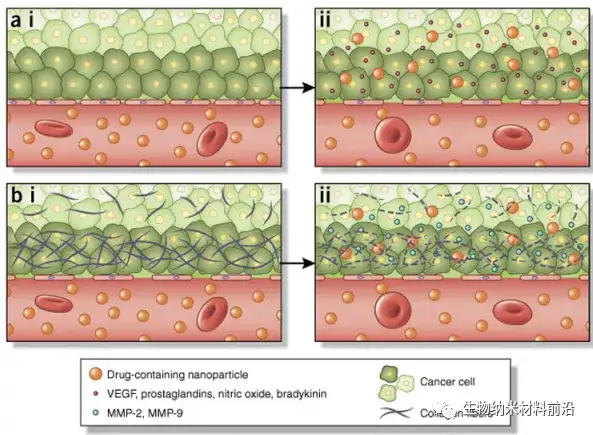
图4. 纳米颗粒引起肿瘤组织渗透性增强的决定因素。 EPR效应3是一种运输现象,其主要特征是肿瘤脉管系统中存在开窗,使纳米粒子在肿瘤中被动积累。(a,i) 正常脉管系统通常具有紧密的内皮间连接,可防止颗粒外渗到组织中。几个因素的不平衡会影响肿瘤血管系统中开窗的大小。(a,ii) 例如,VEGF 和一氧化氮已被证明可以增加内皮细胞间隙的大小。(b,i) 肿瘤通常具有致密的细胞外基质,阻止纳米颗粒充分渗透到肿瘤中。(b,ii) MMP-2 和 MMP-9 降解构成基底膜的致密胶原基质。反过来,这些可以在药理学上加以利用(例如,通过施用抗纤维剂)来增强 EPR 效应,从而增加肿瘤中纳米颗粒的积累。
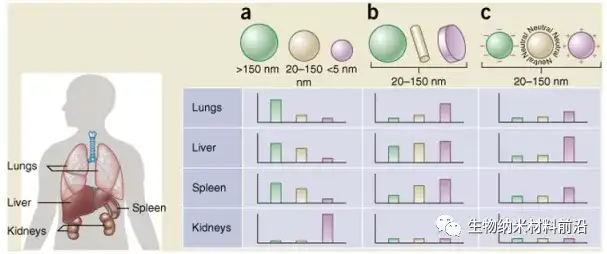
图5.纳米颗粒的大小、形状和表面电荷决定了其在不同器官(包括肺、肝、脾和肾)之间的生物分布。 (a) 球形颗粒,包括金纳米颗粒、脂质体和聚合物胶束/纳米颗粒,其大小可能不同,并显示出不同的体内流向。直径 > 2,000 nm 的大刚性颗粒很容易在脾脏和肝脏以及肺的毛细血管中积聚;直径为100-200 nm 范围内的纳米颗粒通过肿瘤的血管开窗渗出(EPR 效应)并逃脱肝脏和脾脏的过滤;随着尺寸增加到超过 150 nm,越来越多的纳米颗粒被包裹在肝脏和脾脏中;小尺寸纳米颗粒 (<5 nm) 被肾脏过滤掉。(b) 新的“自上而下”和“自下而上”制造技术使探索纳米粒子的不同几何形状成为可能,包括圆柱形和盘状形状,已显示出对药代动力学和生物分布的显着影响。不同的纳米颗粒形状表现出独特的流动特性,显着改变循环寿命、细胞膜相互作用和巨噬细胞摄取,进而影响不同器官之间的生物分布。(c) 源自不同表面化学物质的纳米粒子的电荷影响调理作用、循环时间以及与包含 MPS 的器官的常驻巨噬细胞的相互作用,带正电荷的粒子更容易被肺、肝脏和脾脏中的巨噬细胞隔离。中性和带轻微负电荷的纳米粒子在 MPS的上述器官中具有更长的循环寿命和更少的积累。在 b 和 c 中,假设的纳米颗粒尺寸范围为 20-150 nm。值得注意的是,体内生物分布无疑会根据上述几个参数的相互作用而变化。
目前,纳米颗粒的药物递送领域正在超越传统的范围(例如,传统的几何形状、尺寸或化学物质),这利于设计出专门负责克服连续生物障碍的纳米颗粒。人们越来越意识到,虽然纳米颗粒对于治疗肿瘤过程中的生物屏障确实很复杂,但它们绝不是不可克服的。正如此处所强调的,创新设计实施,例如使用非传统几何形状来改善血管动力学或使用仿生膜功能化以避免吞噬细胞摄取,这已显示出优于现有常规纳米颗粒的明显优势。尽管该领域正在思考克服生物障碍更合理的方法,但这些都应围绕着与这些系统相关的额外复杂性,这将直接影响规模化、大规模生产和相关成本的难易程度。此外,根据设计实施(例如,添加自体细胞衍生的仿生表面),有关质量控制、可重复性和毒性的监管批准等方面可能是额外的障碍。进一步了解控制这些生物屏障及它们在各种疾病状态下的转变,再加上材料科学的创新,将继续促进纳米粒子的开发,这些纳米粒子能够解决这些障碍,以实现有效的、特定于位点的递送。这不仅会导致新疗法的成功转化,而且还将把基于纳米颗粒的药物递送从一个有前途的领域提升为治疗多种疾病的可行且常见的策略。
本信息源自互联网仅供学术交流 ,如有侵权请联系我们立即删除。