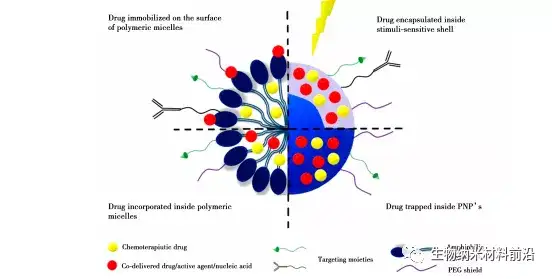
已传文件:photo/1631586161.png
随着现代生活环境和饮食结构的改变,肿瘤发生率和死亡率呈不断上升趋势,仅 2018 年全球新增癌症病例 1 810 万例,死亡病例达 960 万例,其中亚洲新发病例和死亡病例占48.4%和 57.3%。治疗手段除了常规的化疗、放疗、手术治疗外,针对肿瘤在器官组织、分子水平的靶点不同,靶向治疗也取得了不错的成绩。其中,纳米制剂靶向技术利用纳米颗粒作为载体,控制药物在体内的移动和释放,特异地结合在致癌部位并发挥作用,有效改善了药物的体内分布。目前已有部分纳米药物用于临床治疗,比如聚乙二醇修饰的脂质体阿霉素 Doxil、胶束化紫杉醇纳米药物 Genexol®-PM 注射液[4]和脂质体长春新碱 Marqibo®[5] 等,但由于肿瘤具有异质性,在肿瘤细胞生长过程中,子细胞基因发生改变,使肿瘤细胞的生长速度、侵袭能力、药物敏感性等方面产生差异,单包埋药物治疗范围有限易产生耐药性,因此科学家们运用纳米载体共递送不同性质的抗癌药物,降低单一药物大剂量使用的毒副作用,通过多条代谢途径加强对癌细胞的杀伤抑制作用,并且在一定程度上可以逆转多药耐药性。
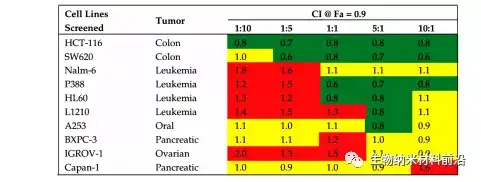
图1.阿糖胞苷和柔红霉素脂质体(CPX-351)协同热图。
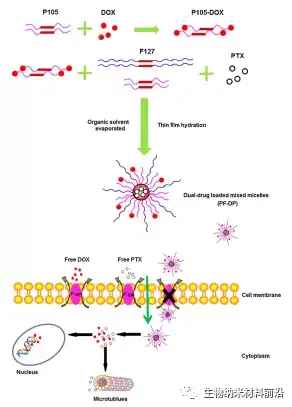
图3.双载药混合胶束的协同效应和逆转多药耐药性示意图。
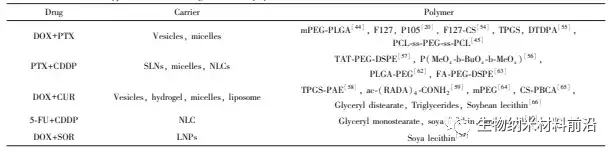
癌症难以治愈在于涉及多种复杂机制且易扩散转移,单一用药只能阻断某一条信号通路,且易产生耐药性使疗效降低,因此可能错过最佳治疗时期来控制癌细胞转移。采用高效的共递送系统不仅能通过药物间的协同作用提高肿瘤治疗效果,并且减少单一药物的使用剂量,降低了毒副作用,纳米载体能够帮助抗肿瘤药物克服溶解性和稳定性差的问题,同时装载不同溶解性的药物,提高递送和入胞效率,并且可抵御溶酶体或其他酶类的降解作用,从而延长循环时间。目前研究比较多的是两种药物的共递送,仍需要进一步解决的问题包括包埋两种药物后粒径有所增大的纳米粒子能否被细胞有摄取,而不是被内皮网状系统和吞噬细胞捕获;共递送纳米药物进入体内后能否同时释放两种有效成分,并且如果代谢降解速率差异太大将无法维持最佳剂量比;如何保证共递送药物的作用效果是协同作用,理想情况是作用机制不同的药物组合能增强疗效,但是阿霉素长春新碱脂质体的研究证明,长春新碱在有丝分裂期积累,阻止细胞进入下一个细胞周期的 S 期,而阿霉素最大效应发生在 S期早期,所以长春新碱可能会抑制阿霉素的活性。除了两种化疗药物联合应用,目前化疗药物与质粒 DNA、siRNA、多肽共同递送也被大量研究,将生物分子包埋在纳米载体内部或键合在载体表面,靶向到肿瘤细胞,作用于与多药耐药相关的基因或蛋白,比如多药耐药基因(MDR1)及其编码的糖蛋白(P-glycoprotein,P-GP)介导的耐药,多药耐药相关蛋白(MRP)、肺耐药蛋白(LRP)等,可以有效逆转肿瘤的多药耐药性。另外也有将诊断剂整合到纳米载体中与化疗药物共递送,应用于肿瘤诊断、癌细胞转移监测等,实现治疗和监测的双功能化。
本信息源自互联网仅供学术交流 ,如有侵权请联系我们立即删除。