已传文件:photo/1631586161.png
肿瘤的光热治疗是一种新兴的肿瘤治疗方法。与传统的治疗方式相比,光热治疗具有较高的特异性和精确的时空选择性,在肿瘤治疗中表现出优异的效果。但由于激光穿透人体组织深度有限,目前光热治疗难以对位于组织深层的肿瘤开展有效治疗。为了进一步促进光热治疗的临床转化,特别是治疗位于组织深层的肿瘤,提高激光的组织穿透深度是非常有必要的。
1合成了在808 nm和1275 nm处具有相近吸收值的聚乙二醇包裹的硫化铜纳米颗粒,并对比了这两种激光在深层组织光热治疗方面的能力。 2 使用5 mm猪肉组织遮挡肿瘤组织以模拟深层组织环境时,1275 nm激光较808 nm激光展现出更为卓越的肿瘤光热治疗效果。
东北大学生命科学与健康学院分子医学研究所刘弘光教授课题组合成了在808 nm和1275 nm处具有相近吸收值的聚乙二醇包裹的硫化铜纳米颗粒 CuS-PEG NPs ,以此为平台,对比了808 nm和1275 nm激光在深层组织光热治疗方面的能力。在对比实验中,1275 nm激光较808 nm激光展现出更高的组织穿透比率,更高的深层组织升温能力以及更有效的深层组织肿瘤杀伤能力。通过鼠尾静脉注射CuS-PEG NPs后开展的光热治疗实验验证了1275 nm激光应用于光热治疗的可行性。
I CuS NPs及CuS-PEG NPs的合成与表征
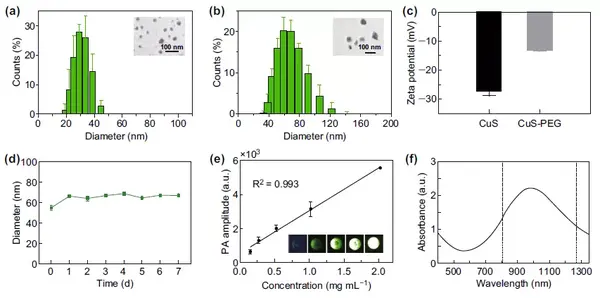
合成了CuS NPs并进一步在表面连接PEG。连接前后纳米颗粒水合粒径增大19 nm,表面电位增大14 mV。CuS-PEG NPs在血清中稳定性较好,7天内水合粒径未发生显著变化。在测试浓度范围内,CuS-PEG NPs的光声信号强度与其浓度成正比。CuS-PEG NPs在808 nm和1275 nm处的吸收值较为接近。
图1(a)CuS NPs的水合粒径与透射电镜图;(b)CuS-PEG NPs的水合粒径与透射电镜图;(c)CuSNPs连接PEG前后表面电位变化;(d)CuS-PEG NPs血清稳定性分析;(e)CuS-PEG NPs光声信号强度与其浓度的关系;(f)CuS-PEG NPs的吸收光谱图。II808 nm和1275 nm激光的体外组织穿透能力对比首先对比了两种激光对于不同厚度猪肉组织的穿透能力。在不同厚度猪肉组织遮挡下,1275 nm激光的穿透比率均高于808 nm激光。随后,通过两种激光照射组织升温,反应组织对于两种激光的散射效应的差异。组织对于1275 nm激光的散射效应较808 nm激光更低。
图2 (a)808 nm和1275 nm激光穿透不同厚度猪肉组织后的剩余激光强度比例;(b)两种激光照射猪肉块组织后的热像图;(c)猪肉块矢状面和水平面上温度高于某一值的相对面积。
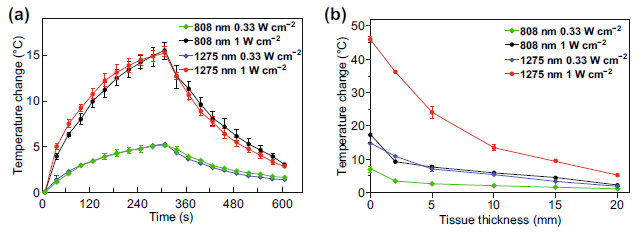
相同功率密度的两种激光照射对应浓度的CuS-PEGNPs溶液,CuS-PEGNPs的升温幅度较为接近。而在覆盖不同厚度猪肉组织以模拟深层环境后,1275nm激光组溶液升温显著高于808nm激光组。
图3 (a)无组织遮挡,不同激光条件照射时CuS-PEG NPs的升温曲线;(b)不同厚度组织遮挡,不同激光条件照射时CuS-PEGNPs溶液的升温曲线。
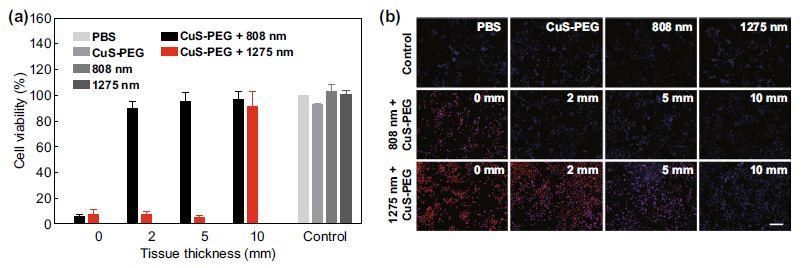
4T-1细胞铺板于96孔板,设置不同条件组别,测试了两种激光对于细胞的杀伤能力。实验结束后通过MTT法测量细胞活力,通过Hoechst 33342和PI双染观察细胞状态。1275 nm激光较808 nm激光显示出更强的深层细胞杀伤能力。
图4 (a)不同厚度猪肉组织遮挡的体外细胞光热实验MTT结果;(b)细胞光热实验后Hoechst-PI荧光双染结果。
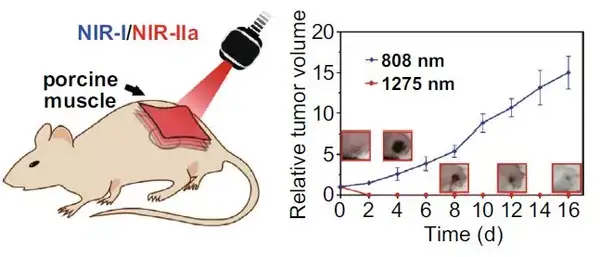
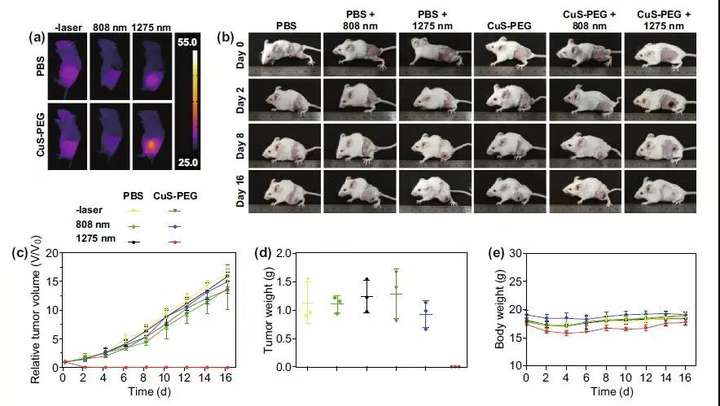
通过皮下接种4T-1细胞,构建荷瘤鼠模型。瘤内注射CuS-PEGNPs或PBS,覆盖5 mm厚猪肉组织,随后照射两种激光。实验结束时记录小鼠全身热像图,并在接下来的16天内持续记录小鼠全身图像、肿瘤体积以及体重。第16天时,记录肿瘤重量。瘤内注射CuS-PEGNPs并照射1275nm激光组显示出良好的肿瘤光热治疗效果,而808nm激光并未能有效杀死肿瘤组织。
图5 (a)光热治疗结束时不同组小鼠全身热像图;(b)光热治疗前后小鼠全身图像;(c)光热治疗结束后肿瘤相对体积变化曲线;(d)光热治疗结束第16天肿瘤相重量;(e)光热治疗结束后小鼠体重变化曲线。
本信息源自互联网仅供学术交流 如有侵权请联系我们立即删除