
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

已传文件:photo/202082583852858.png
腾龙国际上下分客服【521006914微信QQ同步】腾龙官方网站(www.TL9043.com)腾龙国际客服24小时在线,【公司直属客服】【公司直属开户】【大额无忧】支持视频验证现场。
01 硫化物
硫化物是指硫与电负性比它小的元素原子形成的二元化合物,可以分为非金属硫化物和金属硫化物。
非金属硫化物中两种原子之间以共价键结合,多为分子晶体,熔沸点低,常温下为气体或液体,如 CS2;有些非金属硫化物如SiS2,为混合型晶体,熔点较高。极性的分子晶体能溶于水,而非极性的分子晶体和混合型晶体就难溶于水。
金属硫化物是硫与金属元素形成的二元化合物,也可以看做是硫化氢的正盐。硫化氢(H2S)是一种二元弱酸, Ka1=1.07×10-7, Ka2 =1.26×10-13,可以形成正盐和酸式盐;因此其正盐为弱酸盐即硫化物,以质子酸碱理论的观点是一种强碱。
02 金属硫化物金属元素的种类繁多,因而形成的硫化物也多姿多彩,尤其是他们的溶解度和颜色各不相同。
1829年德国人罗斯据此提出了硫化氢系统定性分析方法,这个系统反映的是当时的生产和科学成就,曾经在沉淀分离鉴定的体系中起过非常积极的作用。
现在随着仪器分析方法的发展,硫化氢系统分析虽然已经逐渐被取代,但是仍然是理解无机化学现象的重要依据,尤其是金属硫化物的溶解性是无机化学原理和元素化学现象的一条连接线,也是无机化学理论指导实验的见证点。
一、金属硫化物的溶解性 
二、金属硫化物的溶解性解释——金属硫化物的性质
物质的溶解主要源于相似溶于相似和溶质与溶剂之间发生化学反应两个原因,化学反应又有酸碱反应、氧化还原反应、配位反应等。 
图1金属硫化物的溶解原理图示
1. 金属硫化物的极性
2. 硫化物的酸碱性
(1)酸性硫化物和碱性硫化物
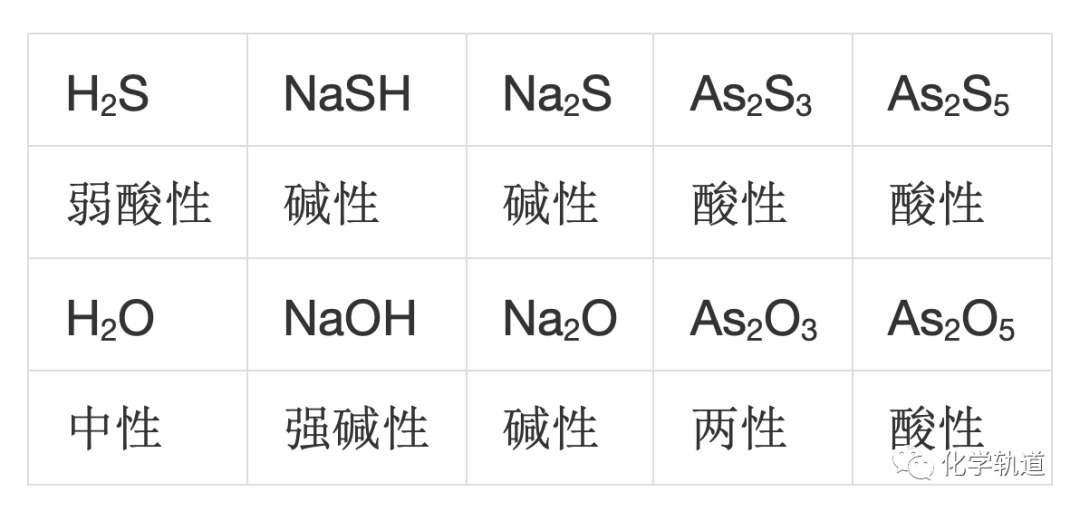
根据与酸或碱的反应可以把氧化物分为酸性氧化物和碱性氧化物。同样,硫化物也分为酸性硫化物和碱性硫化物。表2 硫化物与氧化物的酸碱性

(2)硫化物的酸碱性递变规律
从元素周期表来看硫化物酸碱性的整体递变规律与氧化物的递变规律相同。--- 同周期最高价氧化态的硫化物自左至右酸性增强;--- 同族相同氧化态的硫化物自上至下碱性增强。--- 同元素不同价态的硫化物中高价的酸性更强。
根据酸碱反应原理,酸性硫化物或两性硫化物As2S3, As2S5 , Sb2S3 , Sb2S5 , SnS2可溶于碱(NaOH)、碱性硫化物(Na2S)。As2S3+3Na2S === 2Na3AsS3。(硫代砷酸钠)Na3AsS3 是S 代替含氧酸中的 O 形成的盐,不稳定,可遇水反应Na3AsS3+6H2O === 2H3AsS3+6NaOH2H3AsS3 ==== 3H2S↑+As2S3Na3AsS3+6H2O === 3H2S↑+As2S3↓+6NaOH
(3)溶解金属硫化物所需要的酸度计算
酸碱反应的方向是强酸+强碱===弱碱+弱酸,FeS+2HCl === FeCl2+H2S


硫化物中S2-处于最低氧化态,能够被强氧化剂氧化,因此,不溶于浓的非氧化性酸的硫化物能被氧化性酸如硝酸氧化进而溶解(见表1-行4)。
3CuS+8HNO3 === 3Cu(NO3)2+3S↓+2NO↑+4H2O
同样,如果形成硫化物的金属阳离子具有还原性也能够溶于氧化性酸。位于p区第四周期以下的金属(As、Sb、Bi,Ge、Sn、Pb,Ga、In、Tl)等一般表现出两种常见的氧化态,最高价态即族价(最高氧化态)和比族价低2的氧化数(惰性电子对效应),例如As(Ⅴ,Ⅲ)、Ge(Ⅳ,Ⅱ)、In(Ⅲ,Ⅰ)。因此,低价态的硫化物如As2S3, Sb2S3 , SnS等可以溶于氧化性溶剂。
从氧化剂的角度来看,除了氧化性酸,碱金属硫化物能够溶解过量的单质硫形成多硫化物,多硫化物具有氧化性,因此低价态金属硫化物可以溶于多硫化钠、多硫化铵等多硫化物(见表1-行8)。
对于Kspθ特别小的硫化物,单纯的氧化性酸也不能溶解,就需要双管齐下。例如HgS只能溶于王水(见表1-行5)。
3HgS+2HNO3+12HCl ===3H2[HgCl4]+3S↓+2NO↑+4H2O
王水(HNO3 : HCl = 1: 3),HNO3的强氧化性氧化S2-为S单质,HCl中Cl- 做配体与Hg2+形成稳定的配合物 [HgCl4]2-,使反应向右彻底进行,HgS溶解。
在这个反应中,王水提供了强酸性、强氧化性和配位性,以氧化还原平衡和配位平衡代替了普通非氧化性酸溶解硫化物的沉淀平衡。
实验室制备Al2S3、Cr 2S3只能采用干态制备。
本信息源自互联网仅供学术交流, 如有侵权请联系我们立即删除。
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved.京ICP备16054715-2号 |