陈小元/杨振/范文培Nat Biomed Eng:膜联蛋白A5在肿瘤中的突释通过阻断凋亡细胞的吞噬作用增强细胞毒性T细胞反应
QQ学术交流群:1092348845
详细介绍

癌症免疫疗法,尤其是治疗性疫苗接种,通常不会产生强大的抗肿瘤免疫反应。在此,美国国立卫生研究院陈小元、杨震(标题处姓名有误,特此更正,深表歉意)和中国药科大学范文培实现了在肿瘤中从二硒化物桥连的有机硅制成的静脉注射中空纳米颗粒中爆发释放膜联蛋白A5,通过利用原发肿瘤作为抗原库而产生了强大的抗肿瘤免疫。膜联蛋白A5通过与垂死的肿瘤细胞上的吞噬标记磷脂酰丝氨酸结合,阻断免疫抑制细胞凋亡并促进免疫刺激性继发性坏死。
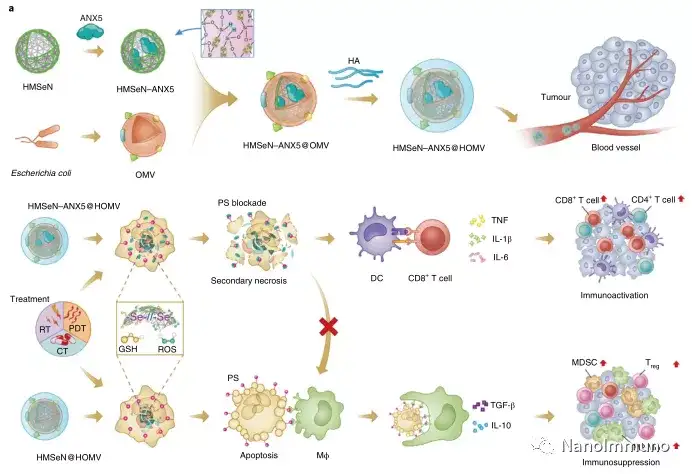

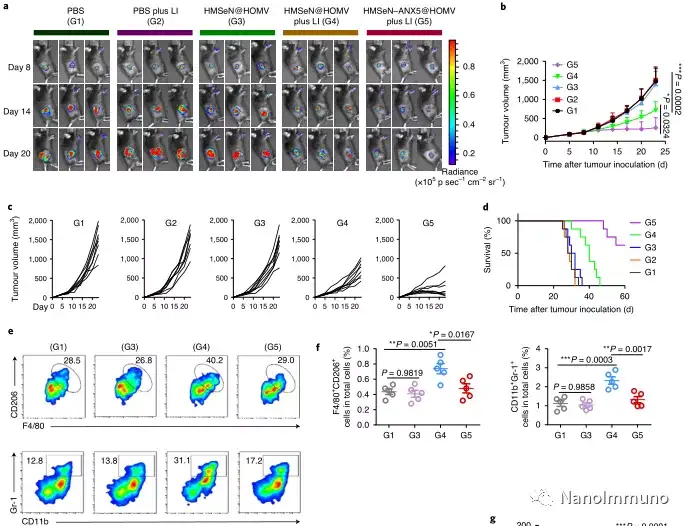
在肿瘤小鼠模型中,由于在肿瘤微环境的氧化条件以及肿瘤细胞的胞内还原条件下的二硒键断裂,导致膜联蛋白A5的爆发释放诱导了系统性细胞毒性T细胞反应以及与肿瘤消退相关的免疫记忆,预防了肿瘤复发,并导致约50%患有原位乳腺肿瘤的小鼠彻底根除肿瘤。通过原位疫苗接种减少凋亡信号传导可能是适应性抗肿瘤免疫反应产生的通用策略。
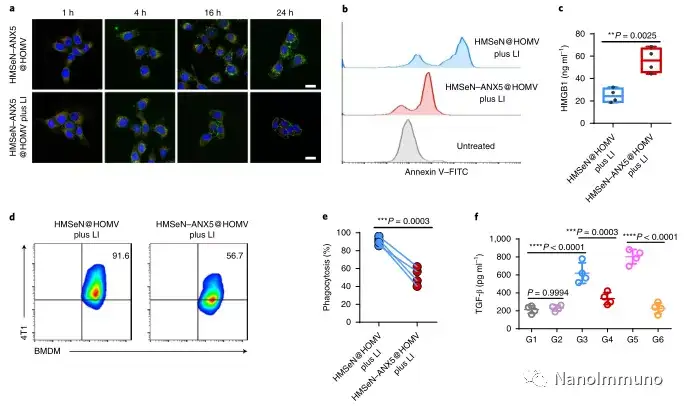
本文描述了一种基于二硒键桥接的HMSeN–ANX5 @ HOMV纳米制剂的多功能纳米技术,可用于原位治疗性疫苗提供个性化的癌症免疫治疗。可生物降解且具有生物相容性的二硒键桥接的大孔HMSeN可以通过简单的混合和孵育而无需添加有机溶剂来固定膜联蛋白A5,从而有助于维持蛋白质有效载荷的生物活性。
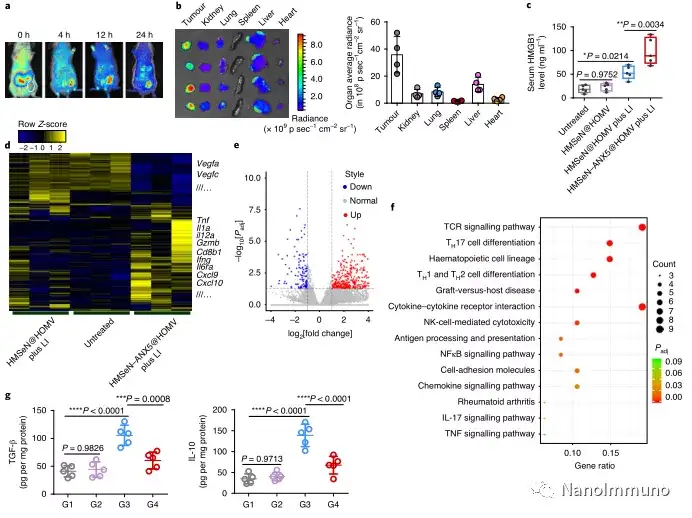
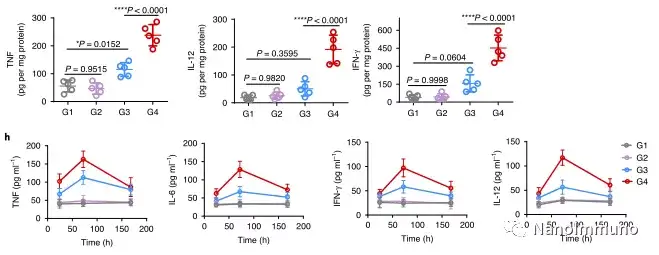
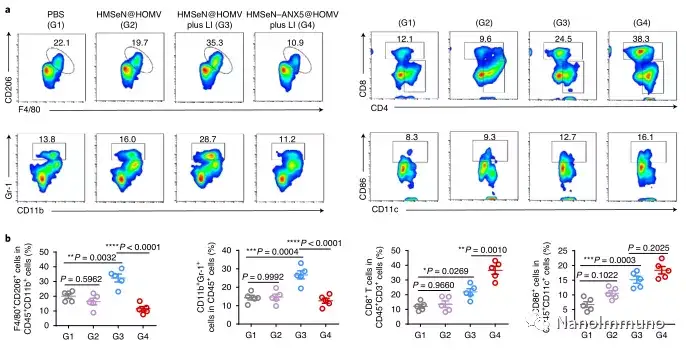
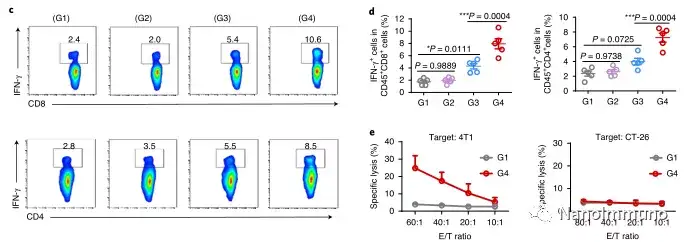
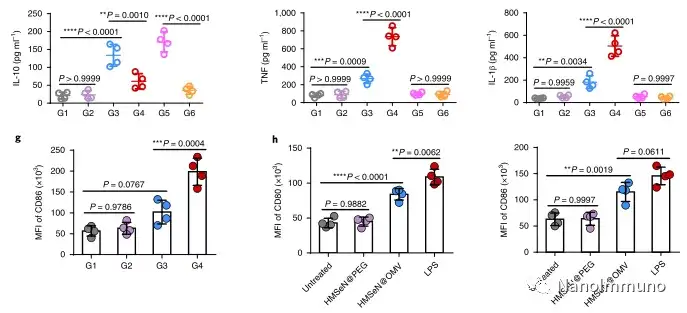
在这项研究中,HMSeN在氧化性肿瘤微环境和生物还原性细胞内环境中均迅速降解,并诱导按需爆发性释放膜联蛋白A5。释放的膜联蛋白A5阻止了磷脂酰丝氨酸在垂死的肿瘤细胞上的暴露,从而阻止了巨噬细胞对其识别,并使免疫抑制性细胞凋亡朝着免疫刺激性继发性坏死转移,从而将肿瘤转变成可触发特异性、强大免疫反应的抗原库。系统给药后,HMSeN–ANX5 @ HOMV引起肿瘤微环境炎症,增强了DC的宿主活化,引发了强大的细胞毒性T细胞免疫应答,并诱导了免疫记忆。
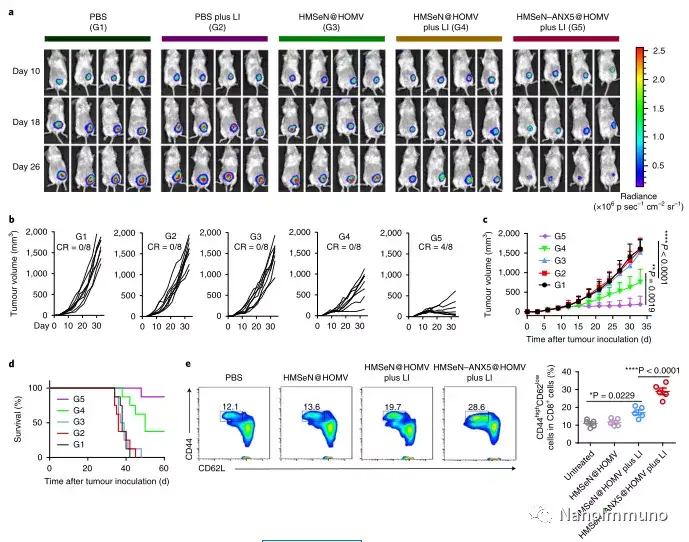
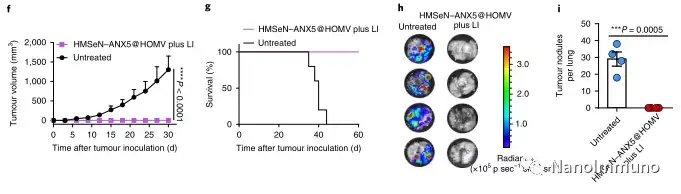
包含一种或几种肿瘤抗原的大多数传统肿瘤疫苗无法克服肿瘤异质性。因此,抗原不一定与特定肿瘤完全相关。在此处描述的方法中,原发肿瘤本身充当原位抗原贮库,其中包含启动强大的抗肿瘤免疫反应所需的所有肿瘤相关抗原表位和损伤相关分子模式。另一个好处是,这种针对原位治疗性疫苗的方法避免了繁琐的体外肿瘤抗原生产。合成无定形二氧化硅通常被美国食品和药物管理局(US Food and Drug Administration)视为安全材料,硒是人体中抗氧化酶的重要成分,有助于潜在的临床转化。总之,鉴于大多数当前的癌症治疗方法均可诱导细胞凋亡,因此原位治疗性疫苗方法可为开发个性化原位肿瘤疫苗提供强大而直接的通用方法。

原文链接:
https://doi.org/10.1038/s41551-020-0599-5
NanoImmuno
本信息源自互联网仅供学术交流 如有侵权请联系我们立即删除
- 上一款: NML综述 | 二维过渡金属碳化物的性质、合
- 下一款: 冉冉升起的 2D 之星:新颖的 MBenes


 学术前沿
学术前沿