韩国国家癌症中心:纳米凝胶增强肿瘤成像和光动力治疗效果
QQ学术交流群:1092348845
详细介绍
本文亮点
1一种基于岩藻多糖的治疗性纳米凝胶,由岩藻多糖主链、氧化还原响应的连接键和光敏剂组成,能够激活肿瘤部位的荧光成像,并增强光动力治疗的疗效,最终诱导癌症完全死亡。2在纳米凝胶平台上使用岩藻糖胶作为聚合骨架,可以通过P-选择素结合实现肿瘤靶向性,并通过抑制血管内皮生长因子的结合增强抗肿瘤作用。
内容简介
本文开发了一种基于岩藻多糖的治疗纳米凝胶(CFN-gel),该凝胶由具有一定抗肿瘤作用的岩藻糖胶主链、氧化还原响应性的连接键和光敏剂Ce6组成,以实现肿瘤部位的可激活近红外(NIR)荧光成像和增强的光动力疗法(PDT),诱导癌细胞完全死亡。CFN-gel通过P-选择素靶向和EPR效应,具有抗血管生成和促进肿瘤部位积聚的作用。此外,CFN-gel在全身给药时无荧光和光毒性。细胞内化后,CFN‑gel的光活性随着细胞内氧化还原电位的变化而恢复,从而实现肿瘤的选择性近红外荧光成像和增强的PDT治疗。本表明,岩藻糖胶纳米凝胶是一种高效、特异的肿瘤影像学和治疗新材料。
图文导读
I CFN‑Gel的表征
首先,用盐酸胱胺对岩藻多糖主链的羧酸进行修饰;然后将Ce6结合成氨基端的岩藻聚糖上来制备CFN-gel。根据1H-NMR计算出,每个岩藻多糖主链上结合20.3 Ce6光敏剂分子。将Ce6-岩藻聚糖结合物冻干并在水溶液中重新分散后可以自组装为纳米凝胶,其水合粒径和zeta电位分别为259±59 nm和-22.2 mV。TEM图像证实了纳米凝胶的形成。CFN-gel有明显的聚集导致荧光淬灭的现象。与含表面活性剂溶液中的CFN-gel相比,PBS溶液中的CFN-gel的荧光强度淬灭了10倍。
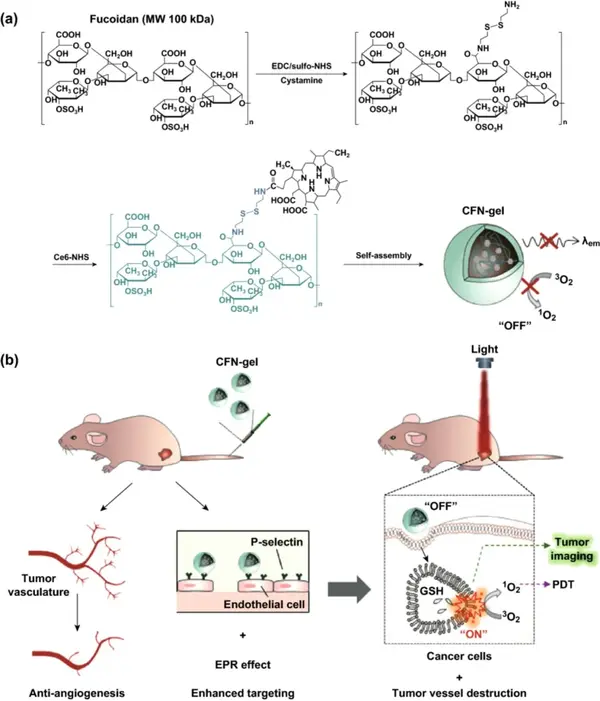
图1 (a)Ce6-岩藻糖胶纳米凝胶(CFN-gel)的合成步骤;(b)CFN-gel及其作用方式示意图。
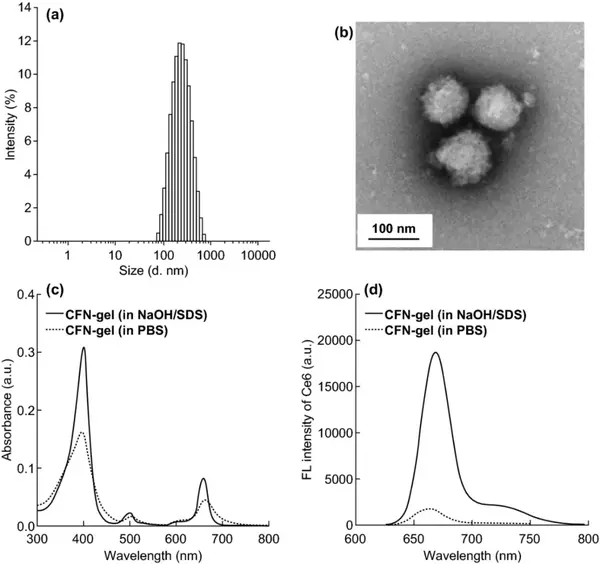
图2 CFN-gel(a)水合粒径的分布;(b)TEM图像。CFN-gel在含表面活性剂和PBS溶液中在2 μM Ce6当量下的紫外/可见吸收光谱(c);荧光发射光谱(d)。
II NIR荧光和SOG的氧化还原响应
在细胞内,CFN-gel中的二硫键通过氧化还原反应裂解释放Ce6分子,从而诱导荧光发射和SOG的生成。当用5 mM DTT处理CFN-gel时,其荧光强度较未用DTT或低浓度DTT处理的凝胶提高了4.9倍,说明二硫键断裂后,CFN-凝胶中聚集的Ce6分子可以有效释放,从而开启CFN-gel的荧光。采用singlet oxygen sensor green(SOSG)作为单重态氧检测试剂,对CFN-gel在670 nm光照下的SOG进行分析。5 mM DTT处理后,CFN-gel SOG的生成量较0或5 μM DTT处理的CFN-gel提高了1.9倍。这些数据表明,CFN-gel具有氧化还原响应荧光发射和光毒性。
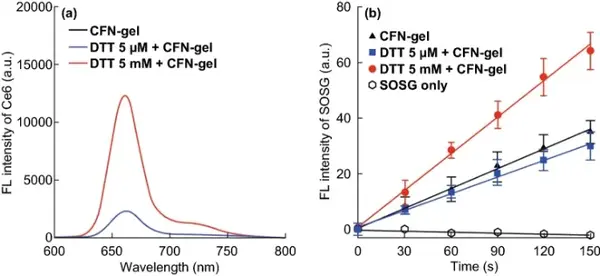
图3 荧光信号的氧化还原响应开启和CFN-gel的单线态氧生成。(a)DTT处理CFN-gel 4 h后的荧光发射光谱;(b)670 nm激光照射下DTT处理的CFN-gel,SOSG荧光随时间的增加(n=4)。
III CFN-gel的SPR分析
通过SPR分析比较CFN-凝胶与VEGF-165和P-选择素的结合特性。VEGF-165与岩藻多糖和CFN-gel的平衡解离速率常数(KD)分别为953.0和756.1 nM。P-选择素与岩藻聚糖和CFN-gel的KD值分别为69.71和718.9 nM。
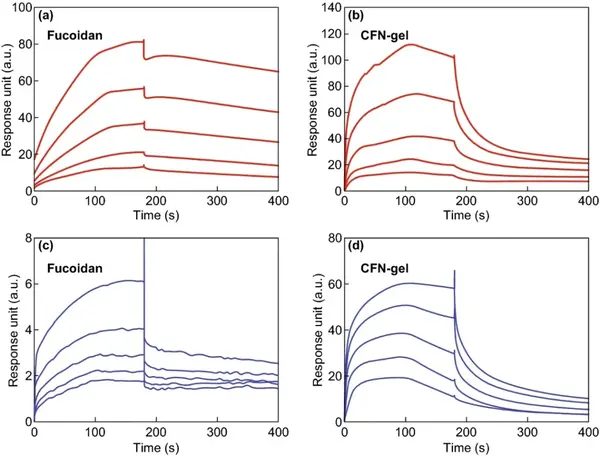
图4 表面等离子体共振(SPR)分析。
IV 体外细胞研究
CFN-gel在含血清蛋白的细胞培养基中具有良好的分散稳定性。HT1080肿瘤细胞内吞实验显示,CFN-gel被有效地内化到肿瘤细胞中,荧光淬灭的Ce6在细胞内经氧化还原响应释放后,荧光被激活。CFN-gel的细胞摄取量至少是游离Ce6的18倍。采用CCK-8法比较细胞存活率,探讨CFN-gel对HT1080癌细胞的体外治疗作用。在没有光照的情况下,试验浓度下,游离Ce6处理6h的癌细胞没有细胞毒性。同样,在0.1至2.5 μM的浓度下,观察到CFN-gel处理的癌细胞没有细胞毒性。随着CFN-gel浓度从5 μM、10 μM和20 μM增加,细胞活力逐渐下降,分别为88.3%、85.9%和60.2%。CFN-gel处理24小时进一步降低了细胞活性,而游离Ce6在高达10 μM的浓度下处理24小时,肿瘤细胞未显示任何细胞毒性作用。用CFN-凝胶或游离Ce6在不同浓度下孵育HT1080细胞6h,用670 nm,10 J/cm2的激光照射(剂量率50 mW/cm2)后,继续孵育24h,结合Ce6的CFN-gel的IC50值约为2.73 μM。相比之下,游离Ce6处理的细胞在光照下没有治疗作用。
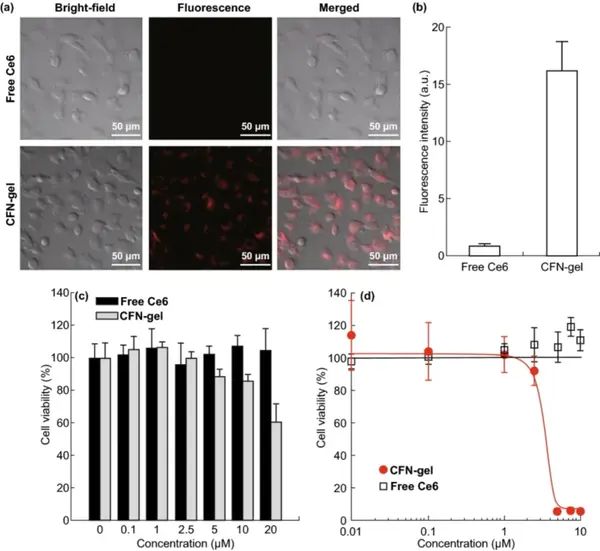
图5 游离Ce6和CFN-gel处理HT1080癌细胞的近红外荧光图像(a);荧光强度的定量分析(b);不同浓度的游离Ce6和CFN-gel对HT1080细胞的体外暗毒性(c);在670 nm光照(50 mW/cm2, 10 J/cm2)下的体外光毒性(d)。
V 体内近红外荧光成像
使用异种移植小鼠肿瘤模型来评估CFN-gel在体内肿瘤成像中的应用。静脉注射后5分钟和24小时获得近红外荧光图像(λex=660/20 nm,λem=710/40 nm)。注射后5 min,游离Ce6处理的小鼠全身呈现高荧光强度,而CFN-gel处理的小鼠则呈现低荧光信号。注射后24小时,在游离Ce6处理的小鼠体内观察到少量荧光信号,说明大部分Ce6从体内清除,而在肿瘤组织中也没有明显的游离Ce6积聚。相反,注射后24小时,CFN-gel处理的小鼠仍能在全身观察到荧光信号,并且肿瘤部位与周围正常组织有明显区别。表明了注射的CFN-gel不仅延长了肿瘤组织的血液循环和肿瘤蓄积,而且还使荧光激活,与体外研究结果一致。收集小鼠的主要器官,可以发现CFN‑gel处理的小鼠,其肿瘤部位有很强的荧光。根据HT1080肿瘤切片CD62P染色,还观察到高P-选择素表达,说明除EPR效应外,P-选择素在肿瘤组织中的高表达增强了CFN-gel的肿瘤靶向性。
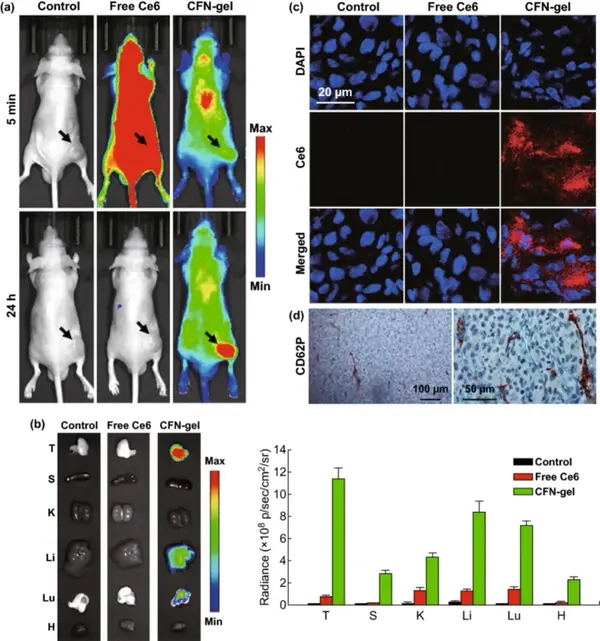
图6 选择性肿瘤成像在异种移植瘤模型中的体内评价。
VI CFN‑Gel的抗肿瘤作用
通过测定HT1080异种移植瘤模型的肿瘤生长率,进一步评价了CFN-gel联合PDT的抗肿瘤作用。CFN-gel+PDT组与PBS组、游离Ce6+PDT组和CFN-gel组相比,体内治疗效果明显增强。TUNEL实验证实了CFN-gel和光照的显著治疗效果。可能由于CFN-gel被内化到P-选择素过度表达的肿瘤血管内皮细胞中并在光照下破坏它们,导致第4组肿瘤切片的CD31染色几乎看不到血管生成性肿瘤血管。
与PBS对照组相比,单独使用CFN凝胶的小鼠在第7-10天显示肿瘤生长延迟,这可能是由于岩藻聚糖本身的抗癌潜力所致。免疫组化染色图像的定量分析显示,与PBS组相比,CFN-gel治疗组的肿瘤中CD31阳性内皮细胞的数量减少了45.3%(***P<0.001),说明CFN-gel具有抗血管生成作用。与PBS组相比,CFN-gel治疗组的肿瘤中凋亡细胞增加了4.9倍(**P<0.01),这表明CFN-gel在肿瘤中的累积诱导了抗肿瘤作用。
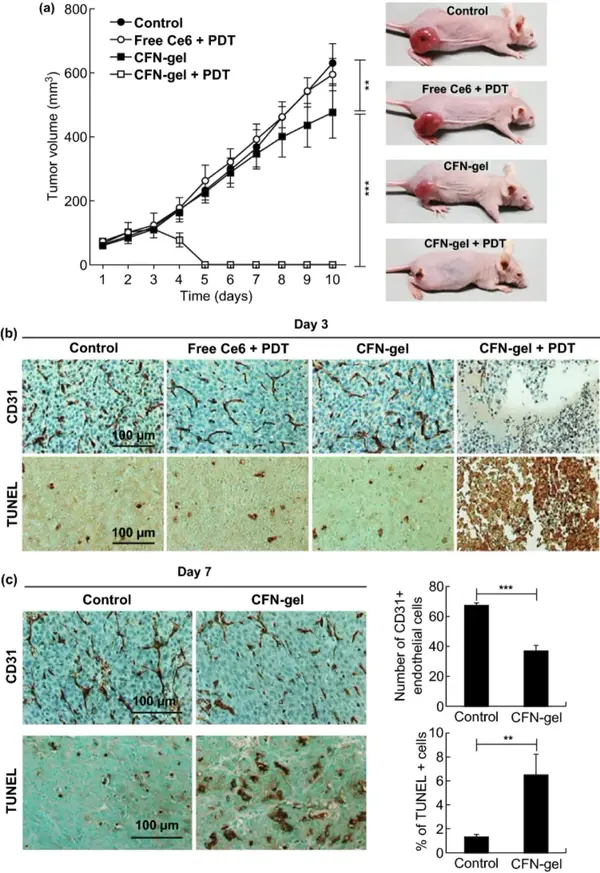
图7 CFN-gel联合PDT体内抗肿瘤活性研究。
VII CFN-gel的体内生物相容性
组织切片H&E染色,主要脏器未见组织病理学异常,小鼠的体重无明显减轻,说明CFN-gel具有良好的生物相容性。
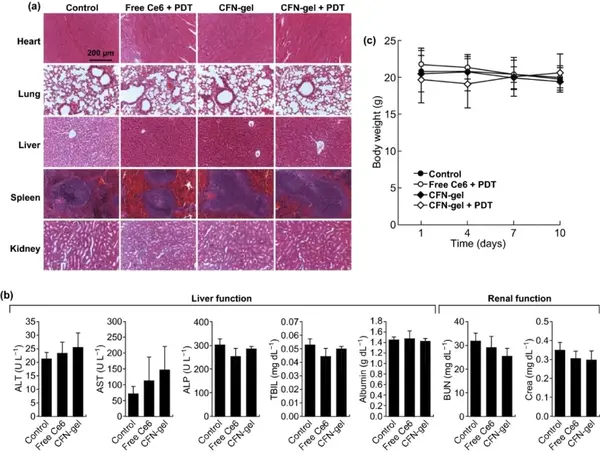
图8 CFN-gel的体内生物相容性。(a)第10天从不同治疗组收集的主要器官的代表性H&E染色图像;(b) PBS、游离Ce6和CFN-gel治疗组小鼠第10天的血液化学数据(n=4);(c)不同组小鼠平均体重随时间的变化。在任何治疗组中,均未观察到明显的器官、血液生物标记物和体重毒性迹象。
撰稿:《纳微快报》编辑部
编辑:《纳微快报》编辑部
本信息源自互联网仅供学术交流 ,如有侵权请联系我们立即删除。
- 上一款: 晏泓教授,JMCA观点:首次使用NaHF2作
- 下一款: 冉冉升起的 2D 之星:新颖的 MBenes

 学术前沿
学术前沿