
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

【研究背景】
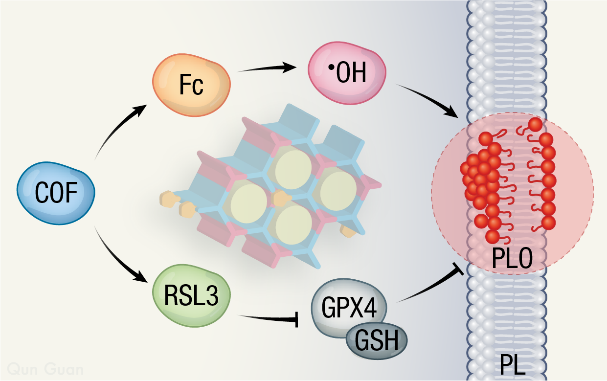
化学动力学治疗(CDT)通过将肿瘤细胞中高浓度的H2O2分解为有毒的·OH(芬顿反应)来诱导细胞死亡。然而,目前,CDT的疗效通常受到细胞内上调的抗氧化防御机制的限制。例如,谷胱甘肽过氧化物酶4(GPX4),在谷胱甘肽(GSH)的参与下可以迅速将·OH氧化产生的磷脂氢过氧化物还原为脂质醇,从而实现脂质修复,规避·OH导致的细胞毒性。为了提高CDT效果,目前常见的做法是采用过渡金属氧化物作为芬顿反应催化剂。这些具有潜在长期毒性的无机材料可能会将现有研究阻滞在实验室阶段,临床转化则面临不可逾越的鸿沟。
【文章概述】
为了增强低金属含量下的CDT效果,山东师范大学董育斌教授课题组设计了纳米药物RSL3@COF-Fc:通过室温下的原位反应,将二茂铁甲醛(FcCHO)掺杂到共价有机框架(COFs)中,并在孔道内负载GPX4抑制剂RSL3。RSL3@COF-Fc颗粒尺寸约170–180 nm,通过胞饮作用进入细胞后,释放的RSL3通过共价抑制GPX4阻断了细胞的主要抗氧化通路,从而破坏细胞内氧化还原稳态;在这种不稳定的情况下,少量Fc通过芬顿反应诱导的·OH足以导致脂质过氧化物积累、亚细胞结构损伤和最终的铁死亡。该研究丰富了COFs纳米材料候选库,为通过破坏氧化还原稳态来增强活性氧介导的肿瘤治疗提供了新的范例。
【图文导读】
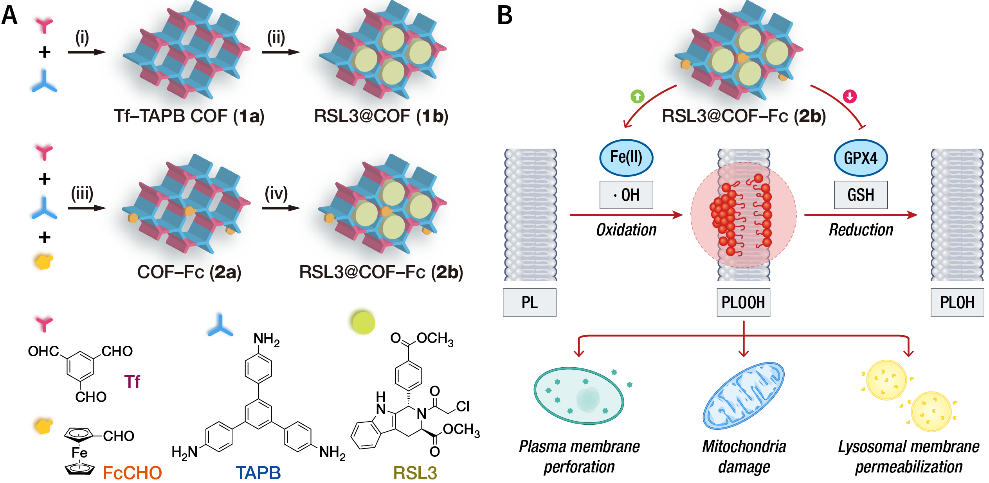
图1. 材料制备和治疗机制示意图。
(A)RSL3@COF-Fc的制备。与经典的COF制备方法(溶剂热)不同,该材料的制备均在室温下完成,易于规模化。
(B)RSL3@COF-Fc通过芬顿反应和GPX4抑制诱导脂质过氧化和亚细胞结构损伤。
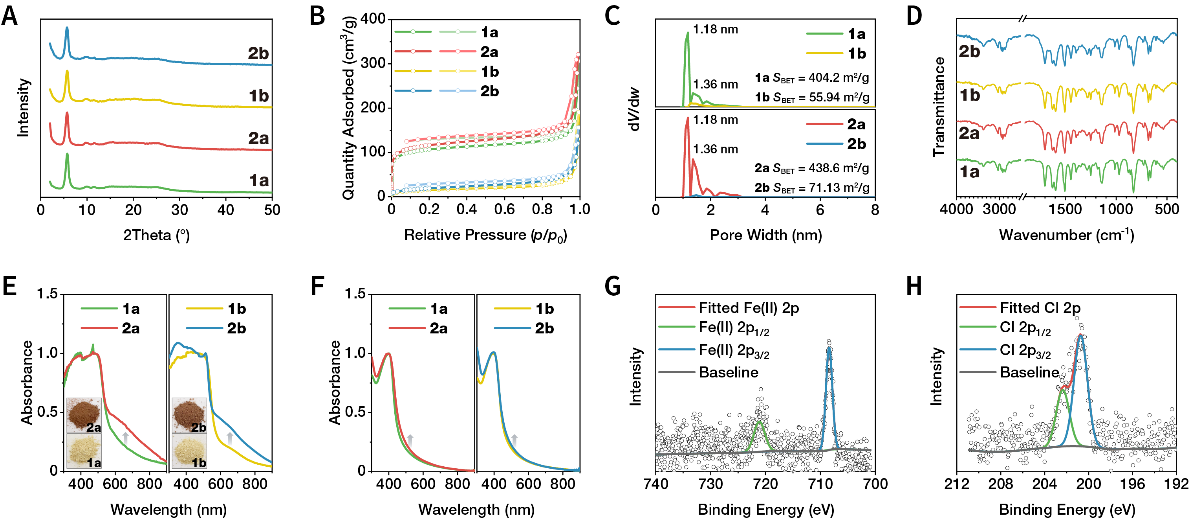
图2. 材料组成表征。
(A)粉末X射线衍射表明材料的晶态周期性结构。
(B)氮气吸附等温线表明材料的多孔性。
(C)孔径分布曲线表明永久孔隙,负载RSL3后孔容降低表明孔内负载。
(D)红外光谱表明Fc的成功修饰和RSL3的加载。
(E)紫外-可见漫反射光谱。
(F)悬浮液的紫外-可见光谱。
(G)Fe的高分辨XPS光谱。
(H)Cl的高分辨XPS光谱。

图3. 形貌表征。材料具有规则的形貌、均匀的尺寸分布、良好的分散性。
(A)扫描电镜。
(B)透射电镜。
(C)HAADF-STEM图像及元素映射分析。
(D)动态光散射分析。

图4. 性质表征。
(A)ABTS作为指示剂,检测COF-Fc诱导H2O2分解产生的·OH。
(B)PBS溶液中的药物释放动力学。
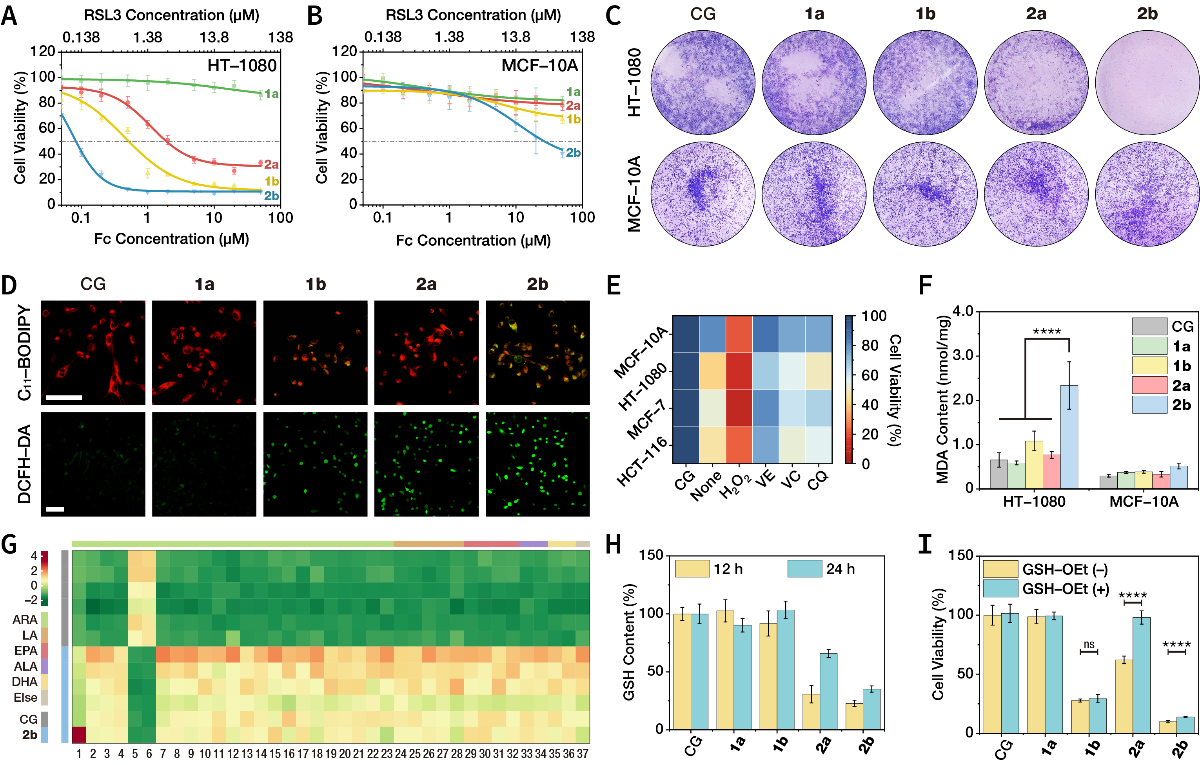
图5. 细胞水平的抗肿瘤治疗。
(A)纳米药物对HT-1080纤维肉瘤细胞的毒性。
(B)纳米药物对MCF-10A乳腺上皮细胞的毒性。
(C)细胞克隆形成实验。
(D)通过C11-BODIPY探针检测纳米药物诱导的脂质过氧化,通过DCFH-DA探针检测纳米药物诱导的细胞内总活性氧积累。
(E)不同类型的活性氧清除剂对治疗效果的弱化或增强作用。
(F)细胞内丙二醛含量检测。
(G)靶向代谢组学分析检测到37种差异代谢物。其中,非酶促脂质过氧化的标志物iPF2α-I含量上调表明了Fc的关键作用。
(H)细胞内GSH含量检测。
(I)外源性GSH挽救了COF-Fc诱导的细胞死亡,但对RSL3@COF-Fc的影响非常有限。
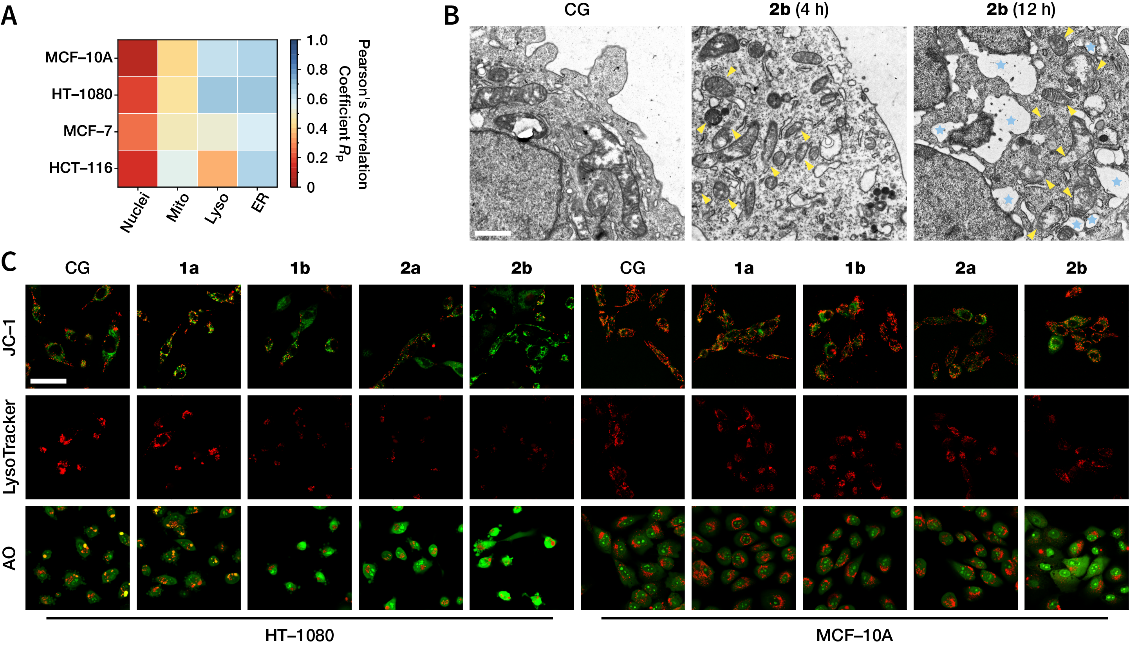
图6. 抗肿瘤治疗对亚细胞结构的影响。
(A)材料的亚细胞分布。
(B)通过细胞透射电镜检测线粒体和溶酶体的形态学改变。
(C)JC-1、LysoTracker、AO荧光探针分别检测线粒体膜电位、溶酶体碱化和溶酶体膜通透性。
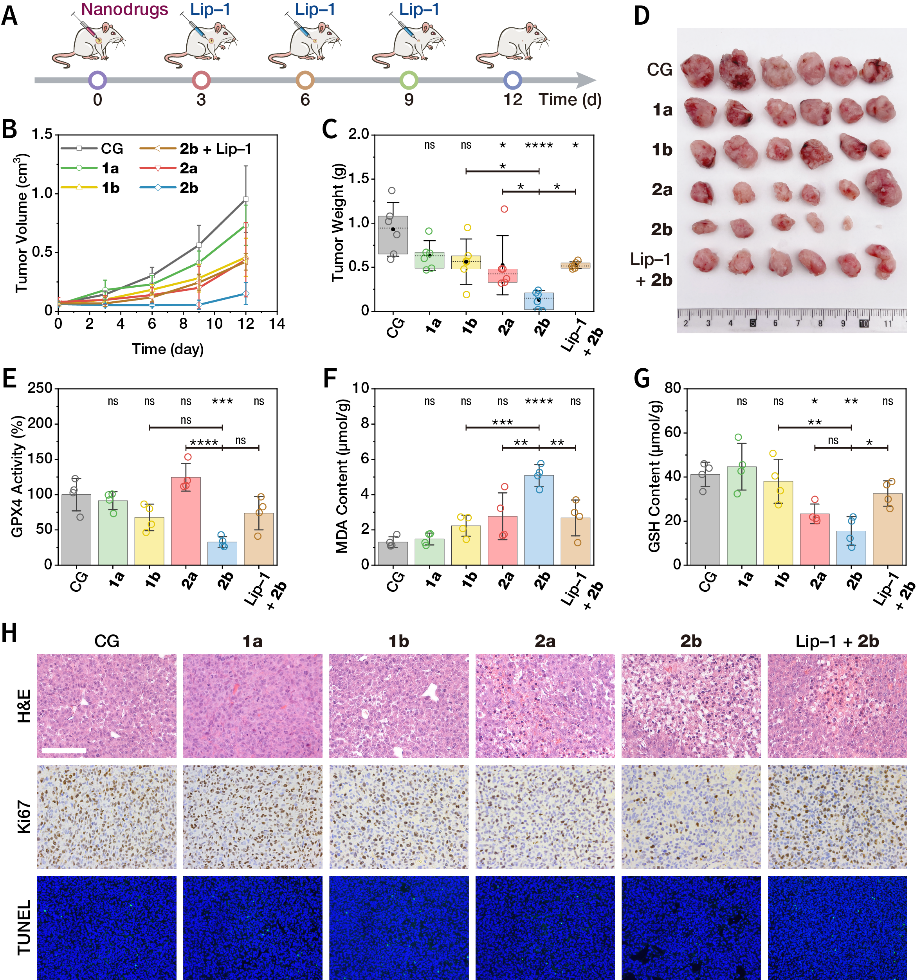
图7. 动物水平的抗肿瘤治疗。
(A)治疗方案示意图。
(B)治疗期间肿瘤体积变化情况。
(C)治疗终点时,肿瘤的质量。
(D)治疗终点时,肿瘤照片。
(E)治疗第7天,肿瘤组织GPX4活性。
(F)治疗第7天,肿瘤组织内丙二醛含量。
(G)治疗第7天,肿瘤组织内GSH含量。
(H)治疗终点时,肿瘤组织的HE、Ki67、TUNEL分析。
本信息源自互联网仅供学术交流 如有侵权请联系我们立即删除
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved.京ICP备16054715-2号 |