Science特刊 | 集齐Science家族5大杂志,用10篇论文召唤癌症治疗神兽!
QQ学术交流群:1092348845
详细介绍
癌症研究快速发展的领域中的最新发展使我们有理由对未来充满希望。这本来自Science期刊家族五大成员杂志的研究论文集,着重介绍了在改善免疫疗法,增强药物递送,确定新的治疗靶标,了解肿瘤微环境以及改善患者反应方面的进展。 奇物论编辑部对该特刊的全部10篇论文进行简要解读,以供大家学习和交流。
1. Science:疫苗联合CAR-T细胞攻克实体瘤治疗瓶颈

注射的“amph-配体”疫苗可促进合成抗原的呈递,并导致CAR-T细胞活化,扩增和增加的肿瘤杀伤力。该系统可能会应用于增强任何CAR-T细胞。

Ma L, et al. Enhanced CAR–T cell activity against solidtumors by vaccine boosting through the chimeric receptor. Science.2019;365(6449):162-8.DOI:10.1126/science.aav8692https://science.sciencemag.org/content/365/6449/162
2. Science:癌症通过DNA突变来逃避靶向治疗

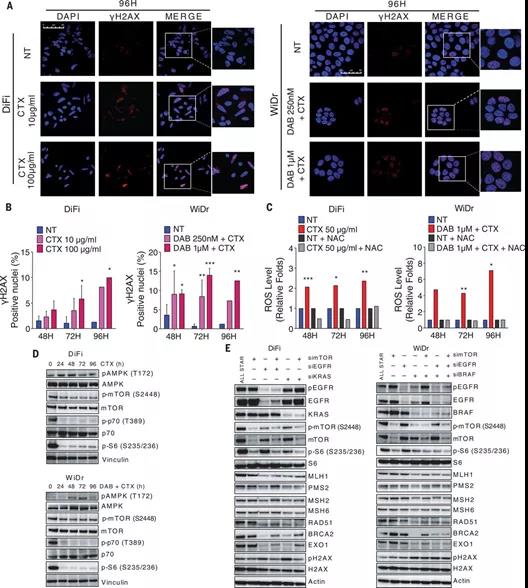
RussoM, Crisafulli G, Sogari A, Reilly NM, Arena S, Lamba S, et al. Adaptivemutability of colorectal cancers in response to targeted therapies. Science.2019;366(6472):1473-80.DOI:10.1126/science.aav4474https://doi.org/10.1126/science.aav4474
3. Science Advances:高效肿瘤选择性纳米颗粒用于肿瘤免疫双靶向治疗

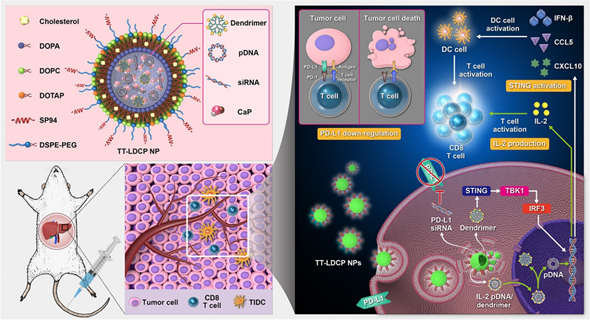
HuangK-W, et al. Highly efficient and tumor-selective nanoparticles fordual-targeted immunogene therapy against cancer. Science Advances.2020;6(3):eaax5032.DOI:10.1126/sciadv.aax5032https://advances.sciencemag.org/content/6/3/eaax5032
4. Science Advances:追踪细胞外囊泡表型变化可以监测黑色素瘤的治疗情况

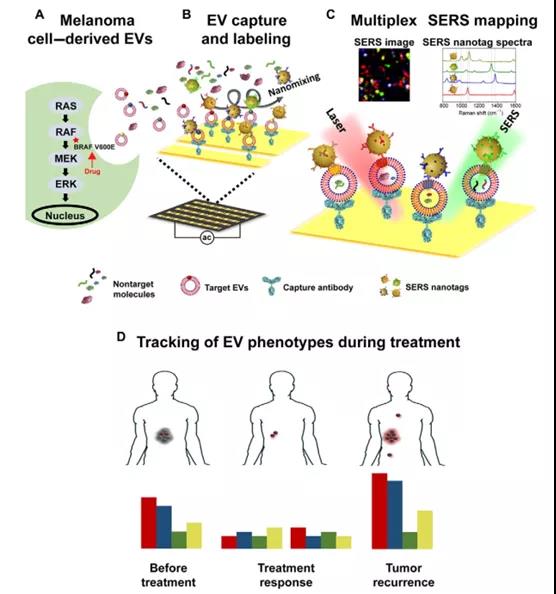
WangJ, et al. Tracking extracellular vesicle phenotypic changes enables treatmentmonitoring in melanoma. Science Advances. 2020;6(9):eaax3223.DOI:10.1126/sciadv.aax3223https://advances.sciencemag.org/content/6/9/eaax3223
5. Science Immunology:髓样细胞中PD-1的靶向缺失可诱导抗肿瘤免疫


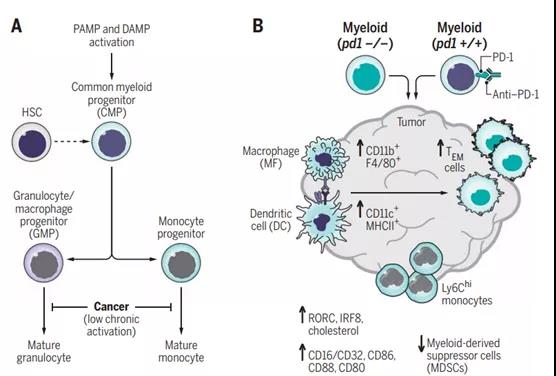
Strauss L, et al. Targeted deletion of PD-1 in myeloid cellsinduces antitumor immunity. Science Immunology. 2020;5(43):eaay1863.DOI:10.1126/sciimmunol.aay1863https://immunology.sciencemag.org/content/5/43/eaay1863
6. Science Immunology:揭示CAR-T疗法引起炎症因子风暴的机理

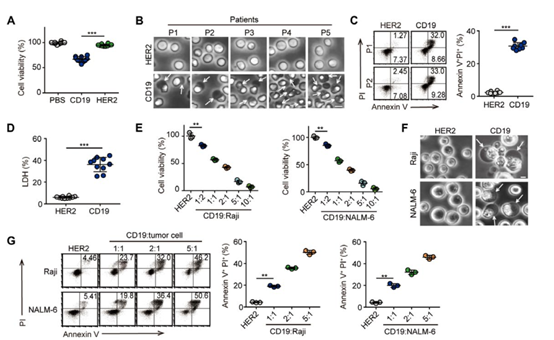
LiuY, et al. Gasdermin E–mediated target cell pyroptosis by CAR T cells triggerscytokine release syndrome. Science Immunology. 2020;5(43):eaax7969.DOI:10.1126/sciimmunol.aax7969https://immunology.sciencemag.org/content/5/43/eaax7969
7. Science Signaling:针对靶向治疗的KRAS突变体等位基因特异性反应的系统机制

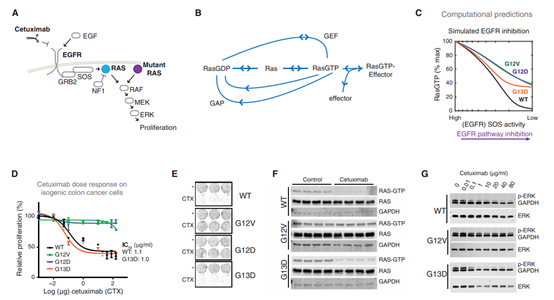
McFallT, et al. A systems mechanism for KRAS mutant allele–specific responses totargeted therapy. Science Signaling. 2019;12(600):eaaw8288.DOI:10.1126/scisignal.aaw8288https://stke.sciencemag.org/content/12/600/eaaw8288
8. Science Signaling:脂肪细胞可触发肿瘤转移

Golan T, et al. Adipocytes sensitize melanoma cells toenvironmental TGF-β cues by repressing the expression of miR-211. ScienceSignaling. 2019;12(591):eaav6847.DOI:10.1126/scisignal.aav6847https://stke.sciencemag.org/content/12/591/eaav6847
9. Science Translational Medicine:抗癌药物可能不会像我们认为的那样起作用

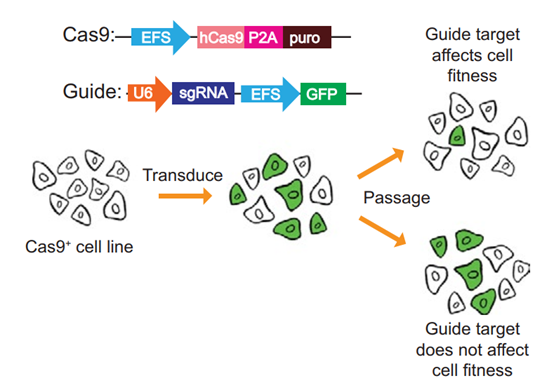
Lin A, et al. Off-target toxicity is a common mechanism of action ofcancer drugs undergoing clinical trials. Science Translational Medicine.2019;11(509):eaaw8412.DOI: 10.1126/scitranslmed.aaw8412https://stm.sciencemag.org/content/11/509/eaaw8412
10. ScienceTranslational Medicine:人乳腺中先天性Vδ1+ γδ T细胞或有助于缓解三阴性乳腺癌

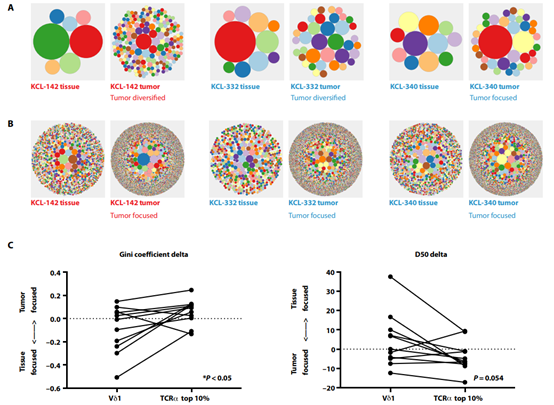

参考资料和下载地址:http://promo.aaas.org/images/Publishing/Journals/2020/Booklet/AACR20_Cancer_Booklet_Online-Final.pdf
信息来源:奇物论
本信息源自互联网仅供学术交流 如有侵权请联系我们立即删除
- 上一款: [转]介孔共价有机框架薄层用于高充放电速率双
- 下一款: 冉冉升起的 2D 之星:新颖的 MBenes

 学术前沿
学术前沿
